© 2024. 作者(们)。
**
图 1. 葡萄糖缺乏通过…增加脂解
**
**
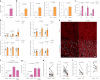
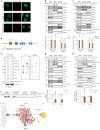
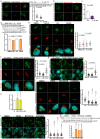
图1. 葡萄糖缺乏通过ATGL稳定化增加脂肪组织和肝脏中的脂解作用。
**
图 1. 葡萄糖缺乏通过 ATGL 稳定化增加脂肪组织和肝脏中的脂解作用。
a,b, 血浆FFA水平的定量 (a) 和肝脏及脂肪储存中的ATGL水平 (b) 在禁食24小时后 (n = 6只小鼠每组)。 c, 小鼠在2-DG (2 g kg−1 BW) 给药后1小时、6小时和12小时的血浆FFA水平 (1 h和6 h, n = 6只生理盐水组小鼠和8只2-DG组小鼠; 12 h, n = 10只生理盐水组小鼠和13只2-DG组小鼠)。 d, 在2-DG给药后1小时、6小时和12小时收集的肝脏和脂肪储存中ATGL水平的定量 (1 h和6 h, n = 6只生理盐水组小鼠和8只2-DG组小鼠; 12 h, n = 12只生理盐水组小鼠和15只2-DG组小鼠)。 e, 在2-DG给药后6小时收集的iBAT中ATGL的代表性免疫荧光。比例尺,20 μm。每组三只小鼠的代表性图像,结果相似。 f, 在2-DG处理5.5小时后,野生型小鼠的血浆FFA水平,随后给予胰岛素 (0.75 U kg−1 BW) 30分钟 (n = 8只小鼠每组)。 g, 在2-DG和胰岛素共同给药6小时后,野生型小鼠的血浆FFA水平 (n = 8只小鼠每组)。 h,i, 在EHC前后从具有胰岛素敏感性或抵抗性的患者中提取的皮下脂肪组织中ATGL和HSLSer660ph水平的定量 (n = 16名具有胰岛素敏感性的患者在 h; n = 8名具有胰岛素抵抗的患者在 i)。数据以均值±标准误表示,并使用双尾未配对 t est (a–d (肝脏1 h, iBAT, iWAT的1 h和6 h,以及gWAT的1 h和6 h)), 双尾配对 t est (i), 双尾Mann–Whitney检验 (d (肝脏的6 h和12 h, iWAT的12 h和gWAT的12 h)), 双尾Wilcoxon检验 (h) 和带Tukey校正的单向ANOVA方法 (f 和 g)。源数值数据可在 . Source data
**
图 2. 葡萄糖缺乏通过…调节脂解
**
**
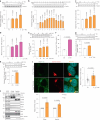
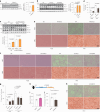
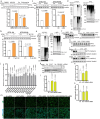
图 2. 葡萄糖缺乏通过稳定高甘油三酯酶 (ATGL) 在高尔基体中调节脂解。
**
图 2. 葡萄糖缺乏通过稳定高甘油三酯脂肪酶 (ATGL) 在高尔基体中调节脂解。
a, 在不同葡萄糖 (Glc) 浓度下培养的 HepG2 细胞中 ATGL 的免疫印迹,培养 6 小时 (n = 每组 6 次独立实验)。 b, 在用 50 mM 2-DG 处理的 HepG2 细胞中 ATGL 的免疫印迹,在指定时间点收集 (n = 对照组或 2-DG 组 9 或 3 次独立实验)。 c, 在不同葡萄糖浓度下培养的 iBAs 中 ATGL 的免疫印迹,培养 24 小时 (n = 每组 6 次独立实验)。 d, 在基线状态下,iBAs 在不同葡萄糖浓度处理后 24 小时释放的饥饿培养基中的 NEFAs 水平 (n = 每组 6 次独立实验)。 e, 在指定浓度下用 2-DG 处理的 iBAs 中 ATGL 的免疫印迹,培养 24 小时 (n = 每组 4 次独立实验)。 f, 在基线状态下,iBAs 在用对照载体 (Ctr) 和 100 mM 2-DG 处理后 24 小时释放的饥饿培养基中的 NEFAs 水平 (n = 每组 5 次独立实验)。 g, 在葡萄糖撤除 6 小时后 HEK293T 细胞中 ATGL 的免疫印迹 (n = 每组 4 次独立实验)。 h, 在用 Ctr 和 50 mM 2-DG 处理 12 小时后 HEK293T 细胞中 ATGL 的免疫印迹 (n = 每组 4 次独立实验)。 i, 在用无葡萄糖培养基处理 6 小时后 HEK293-AAV 细胞中 ATGL 的免疫荧光 (n = 每组 43 个细胞)。比例尺,5 μm。 j, 在葡萄糖撤除 6 小时后从 HEK293T 细胞提取的 WCE、Golgi 和囊泡分馏中 ATGL 的免疫印迹 (n = 每组 6 次独立实验)。结果以均值 ± s.e.m. 表示,并使用双尾未配对 t ext{-test} (f–i)、双尾配对 t ext{-test} (j)、使用 Dunnett 校正的单向 ANOVA 方法进行对照组与其他组之间的多重比较 (a–c 和 e),以及使用 Dunn 校正的 Kruskal–Wallis 检验进行对照组与其他组之间的多重比较 (d)。源数值数据和未处理的印迹可在 . Source data 中获得。
**
图 3. Golgi PtdIns4P 调节 ATGL 蛋白…
**
**
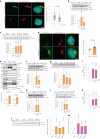
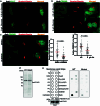
图3. Golgi PtdIns4P 调节 Golgi 体内 ATGL 蛋白的稳定性。
**
图 3. 高尔基体 PtdIns4P 调节高尔基体中 ATGL 蛋白的稳定性。
a, 在葡萄糖剥夺后对 HEK293-AAV 细胞中 PtdIns4P 的免疫荧光 (n = 150 细胞每组)。比例尺,5 μm。b, 在 PI4KB 和 SACM1L 基因敲除后 72 小时对 HEK293T 细胞中 ATGL 的免疫印迹 (n = 8 或 4 个独立实验用于对照组或其他组)。c, 在用 5 μM PIK93、10 μM BF738735 和 10 μM UCB9608 处理后 24 小时对 HEK293T 细胞中 ATGL 的免疫印迹 (n = 6 个独立实验每组)。d, 在 UCB9608 处理后 24 小时对 HEK293-AAV 细胞中 ATGL 的免疫荧光 (n = 61 细胞每组)。比例尺,5 μm。e, 在 UCB9608 处理后 6 小时对 HEK293T 细胞不同分馏中的 ATGL 进行免疫印迹 (n = 6 个独立实验每组)。f, 在 PI4KB 和 SACM1L 基因敲除后 72 小时对 HepG2 细胞中 ATGL 的免疫印迹 (n = 8 或 4 个独立实验用于对照组或其他组)。g, 在用 PIK93、BF738735 和 UCB9608 处理后 24 小时对 HepG2 细胞中 ATGL 的免疫印迹 (n = 6 个独立实验每组)。h,i, 在 iBAs 中敲除 Pi4kb 后 72 小时对 ATGL 的免疫印迹和基础脂解的测定 (n = 8 或 4 个独立实验用于对照组或其他组在 h 中;n = 6 个独立实验每组在 i 中)。j,k, 在 iBAs 中敲除 Sacm1l 后 72 小时对 ATGL 的免疫印迹和基础脂解的测定 (n = 6 或 4 个独立实验用于对照组或其他组在 j 中;n = 6 个独立实验每组在 k 中)。l,m, 在用 1 μM PIK93、1 μM BF738735 和 1 μM UCB9608 处理 iBAs 后 24 小时对 ATGL (l) 和基础脂解 (m) 的免疫印迹 (n = 6 个独立实验每组)。数据以均值 ± 标准误表示,并使用双尾配对 t ext{-test} (e)、双尾 Mann–Whitney 检验 (a 和 d)、使用 Dunnett 校正的单因素方差分析法进行对照组与其他组之间的多重比较 (b, c, f–k 和 m),以及使用 Dunn 校正的 Kruskal–Wallis 检验进行对照组与其他组之间的多重比较 (l)。源数值数据和未处理的印迹可在 . Source data
**
图4. 高尔基体驻留的E3连接酶…
**
**
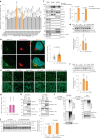
图4. 高尔基体驻留的E3连接酶复合体CUL7 FBXW8多泛素化ATGL以进行降解.
**
图4. 高尔基体驻留的E3连接酶复合体CUL7FBXW8对ATGL进行多泛素化以促其降解。
a, HEK293T WCE中ATGL蛋白水平的定量,通过免疫印迹进行小规模siRNA筛选(n = 18或3个独立实验用于对照组或其他组)。b, HEK293-AAV细胞中ATGL的免疫荧光,CUL7&_FBXW8_敲低后72小时(n = 每组61个细胞)。比例尺,5 μm。c, 从HEK293T细胞中提取的WCE、Golgi和囊泡分馏中ATGL的免疫印迹,CUL7&_FBXW8_敲低后72小时(n = 每组6个独立实验)。星号表示非特异性条带。d, HepG2细胞中ATGL的免疫印迹,CUL7_和_FBXXW8_敲低后72小时(n = 8或4个独立实验用于对照组或其他组)。e, HepG2细胞中siRNA敲低后72小时用BODIPY染色的LDs代表性图像。比例尺,20 μm。三次独立重复,结果相似。f, iBAs中ATGL的免疫印迹,Cul7_和_Fbxw8_敲低后72小时(n = 8或4个独立实验用于对照组或其他组)。g, 敲低_Cul7_和_Fbxw8_后,iBAs在基础状态下释放的饥饿培养基中NEFAs水平(n = 每组6个独立实验)。h, 在HEK293T WCE中通过FLAG抗体进行的共免疫沉淀,表达ATGL–FLAG或FBXW8–FLAG后48小时。三次独立重复,结果相似。i, 在转染ATGL–FLAG的HEK293T细胞中检测K48连接的多泛素化模式,随后进行siRNA转染72小时并进行免疫沉淀以富集ATGL–FLAG。四次独立重复,结果相似。j, HEK293T细胞中在缺乏CUL7FBXW8的情况下,葡萄糖撤除后6小时的ATGL免疫印迹(n = 每组5个独立实验)。数据以均值±标准误表示,并使用双尾未配对_t-检验(b和j)、双尾配对_t-检验(c)、使用Dunnett校正的单因素方差分析法进行对照组与其他组之间的多重比较(a、d和f)以及使用Kruskal–Wallis检验和Dunn校正进行对照组与其他组之间的多重比较(g)。源数值数据和未处理的印迹可在源数据中获得。
**
图 5. FBXW8 的招募到…
**
**
图5. FBXW8通过与PtdIns4P的相互作用招募到高尔基体。
**
图 5. 通过与 PtdIns4P 的相互作用招募 FBXW8 到高尔基体。
a, CUL7、FBXW8 和异位表达的 FBXW8–FLAG 在 HEK293-AAV 细胞中用指示抗体染色的免疫荧光代表性光镜图。比例尺,5 μm。独立重复三次,结果相似。 b,c, 在葡萄糖撤除或 UCB9608 处理后,从 HEK293T 细胞提取的 WCE、内质网和囊泡分馏中的 CUL7 和 FBXW8 的免疫印迹 (n = 6 个独立实验每组)。星号表示非特异性条带。 d, 人类 FBXW8 结构域的示意图。 e, 与重组蛋白 FBXW8–FLAG 和 FBXW8 突变体–FLAG 共同孵育的 PIP 条带的印迹分析。独立重复三次,结果相似。 f, 通过 PtdIns4P 琼脂糖珠拉下的重组蛋白 FBXW8–FLAG 和 FBXW8 突变体–FLAG 的免疫印迹。独立重复三次,结果相似。 g,h, 在葡萄糖撤除后,从 HEK293T 细胞提取的 WCE、内质网和囊泡分馏中的 FBXW8–FLAG 和 FBXW8 突变体–FLAG 的免疫印迹 (n = 6 个独立实验每组)。 i, 示意图说明了葡萄糖可用性如何通过内质网 PtdIns4P 与脂解作用相耦合的机制工作模型。结果以均值 ± 标准误表示,并使用双尾配对 t ext{-test} 进行分析 (b, c, g 和 h)。源数值数据和未处理的印迹可在 . Source data 中获得。
**
图6. 脂解和MASLD的调节…
**
**
图6. 通过操控高尔基体 PtdIns4P–CUL7 FBXW8 –ATGL 轴调节脂解和 MASLD 发展。
**
图6. 通过操控高尔基体 PtdIns4P–CUL7FBXW8–ATGL 轴调节脂解和 MASLD 发展。
a, ATGL蛋白在肝脏中的免疫印迹,来自肝细胞特异性 Pi4kb 敲除小鼠,在AAV8给药后2周(n = 每组8只小鼠)。 b, ATGL蛋白在肝脏中的免疫印迹,来自肝细胞特异性 Cul7 和 Fbxw8 敲除小鼠,在AAV8给药后2周(n = 每组6只小鼠)。 c, ATGL蛋白在肝脏中的免疫印迹,在肝细胞中 Cul7 和 Fbxw8 双敲除背景下,2-DG注射后1小时(n = 每组6只小鼠)。 d, 在NCD喂养小鼠中,AAV8给药后4周或在HFD喂养小鼠中,AAV8给药后8周,肝脏TG水平的测定(n = 每组NCD 10只小鼠和HFD 5只小鼠)。 e,f, 在NCD和HFD喂养条件下,来自肝细胞特异性 Pi4kb (e)、Cul7 和 Fbxw8 (f) 敲除小鼠的肝脏H&E和ORO染色。比例尺,200 μm。每组五只小鼠的代表性图像,结果相似。 g, 在AAV8给药后,NCD和HFD喂养的肝细胞特异性 Cul7 和 Fbxw8 敲除小鼠中肝脏TG水平的测定(n = 每组NCD 11只小鼠和HFD 5只小鼠)。 h, 向野生型小鼠给药UCB9608的实验设计示意图。 i, 在DMSO和UCB9608给药后8周,野生型小鼠的血浆FFA水平(n = 每组12只小鼠)。 j, DMSO和UCB9608处理小鼠的肝脏TG水平(n = 每组15只小鼠)。 k, DMSO和UCB9608处理小鼠的肝脏H&E和ORO染色。比例尺,200 μm。每组十只小鼠的代表性图像,结果相似。数据以均值±标准误表示,并使用双尾未配对 t est(a, c, d 和 j)、双尾Mann–Whitney检验(i)以及使用Dunnett校正的单向ANOVA方法进行控制组与其他组之间的多重比较(b 和 g)。源数值数据和未处理的印迹可在 . Source data
**
图7. 小鼠MASH进展的改善…
**
**
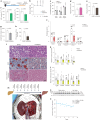
图7. 通过阻断…改善小鼠MASH进展和人类肝移植中的脂肪变性
**
图7. 通过阻断高尔基体PtdIns4P生成改善小鼠MASH进展和人类肝移植中的脂肪变性。
a, 实验设计示意图,向野生型小鼠施用UCB9608,在高脂饮食、高葡萄糖/果糖含水和热中性环境下诱导MASH。b, UCB9608治疗期间的体重增加(n = 10只小鼠每组)。c, 对MASH小鼠的瘦体重、脂肪量和体重的EchoMRI分析(n = 10只小鼠每组)。d,e, UCB9608施用12周后的血浆FFA水平(d)和TG水平(e)(n = 10只小鼠每组)。f, MASH小鼠施用UCB9608后血浆中的丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)活性(n = 10只小鼠每组)。g, MASH小鼠施用UCB9608后的肝脏质量/体重比(n = 10只小鼠每组)。h, MASH小鼠施用UCB9608后的肝脏TG水平测定(n = 10只小鼠每组)。i, H&E染色、ORO染色和Gomori绿色三色染色的代表性图像。比例尺,25 μm。每组十只小鼠的代表性图像,结果相似。j, 用DMSO和UCB9608处理的MASH小鼠肝脏的组织学评分(n = 10只小鼠每组)。k,l, 通过qPCR确定的MASH肝脏中炎症标志物(k)和纤维化标志物(l)的转录水平(n = 10只小鼠每组)。m, 在常温机器灌注期间向人类肝脏移植物施用UCB9608的实验设计示意图。n,o, ATGL蛋白的免疫印迹及从两个叶片不同时间点取的人类肝活检中TG水平的定量。技术上重复三次,结果相似。结果以均值±标准误表示,并使用双尾未配对_t_-检验(b–g和k(Ccl2和Tnfα)和l(Col1a2、Timp1和Acta2))、双尾Mann–Whitney检验(h、j和k(Emr1和Il1b)和l(Tgfb1和Col1a1))以及双尾Pearson相关性(o)进行分析。源数值数据和未处理的印迹可在源数据中获得。
**
扩展数据图 1. ATGL 驱动的脂解是…
**
**
扩展数据图 1. ATGL 驱动的脂解在肝脏和脂肪储存中增加…
**
扩展数据图 1. ATGL驱动的脂解在禁食和缺乏葡萄糖的小鼠的肝脏和脂肪储存中增加。
(a) 饮食和禁食小鼠肝脏和脂肪储存中的 ATGL、HSLSer660ph、HSL、MGL、PLIN1、CGI-58 和 HSP90 的免疫印迹。(b) 野生型小鼠在 2-DG (2 g/kg BW) 给药后 1 小时、6 小时和 12 小时的血浆葡萄糖水平(1 小时和 6 小时,生理盐水组 n = 6 只小鼠,2-DG 组 n = 8 只小鼠;12 小时,生理盐水组 n = 6 只小鼠,2-DG 组 n = 7 只小鼠)。(c–e) 在 2-DG (2 g/kg BW) 给药后 1 小时和 6 小时收集的野生型小鼠肝脏中的葡萄糖和葡萄糖衍生物(葡萄糖-6-p 和 GA3P)水平(生理盐水组 n = 6 只小鼠,2-DG 组 n = 8 只小鼠)。(f) 野生型小鼠在 2-DG (2 g/kg BW) 给药后 1 小时、6 小时和 12 小时的血浆胰岛素水平(1 小时和 6 小时,生理盐水组 n = 6 只小鼠,2-DG 组 n = 8 只小鼠;12 小时,生理盐水组 n = 6 只小鼠,2-DG 组 n = 7 只小鼠)。(g) 在 2-DG (2 g/kg BW) 给药后 1 小时、6 小时和 12 小时收集的肝脏和脂肪储存中的 ATGL、HSLSer660ph、HSL 和 HSP90 的免疫印迹。(h) 在 2-DG (2 g/kg BW) 给药后 1 小时、6 小时和 12 小时收集的脂肪储存中 HSLSer660ph 水平的定量(1 小时和 6 小时,生理盐水组 n = 6 只小鼠,2-DG 组 n = 8 只小鼠;12 小时,生理盐水组 n = 12 只小鼠,2-DG 组 n = 15 只小鼠)。结果以均值 ± 标准误表示,并使用双尾非配对 t-检验(b (12 小时),c (1 小时),d (6 小时),e,f 和 h (iBAT、iWAT 和 gWAT 中的 1 小时和 12 小时))和双尾 Mann-Whitney 检验(b (1 小时和 6 小时),c (6 小时),d (1 小时) 和 h (iBAT 中的 6 小时))进行分析。源数值数据和未处理的印迹可在源数据中获得。源数据
**
扩展数据图 2. 葡萄糖缺乏升高…
**
**
扩展数据图 2. 葡萄糖缺乏通过上调脂肪组织中的 ATGL 提高全身脂解…
**
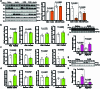
扩展数据图 2. 葡萄糖缺乏通过上调脂肪组织中的 ATGL 独立于转录变化提高全身脂解。
(a) 野生型小鼠在接受2-DG (2 g/kg BW)处理5.5小时后,随后注射胰岛素 (0.75 U/kg BW) 30分钟,从gWAT中提取的ATGL、HSLSer660ph、HSL、AKT1、AKT1Ser473ph和HSP90的免疫印迹。(b) 通过qPCR定量禁食小鼠肝脏和脂肪储存中的_Atgl_转录水平 (每组n = 6只小鼠)。(c) 定量在2-DG (2 g/kg BW)给药1小时后收集的肝脏和脂肪储存中的_Atgl_转录水平 (生理盐水组n = 6只小鼠,2-DG组n = 8只小鼠)。(d) 定量在2-DG (2 g/kg BW)给药6小时后收集的肝脏和脂肪储存中的_Atgl_转录水平 (生理盐水组n = 6只小鼠,2-DG组n = 8只小鼠)。(e–f) 在肝脏特异性_Atgl_敲除小鼠 (AtglLKO) 中进行ATGL的免疫印迹,并测定在2-DG (2 g/kg BW)给药6小时后的血浆FFA水平 (WT: 生理盐水组n = 8只小鼠,2-DG组n = 7只小鼠;AtglLKO_小鼠:每组n = 7只小鼠)。(g–h) 在脂肪组织特异性_Atgl_敲除小鼠 (AtglAKO) 中进行ATGL的免疫印迹,并测定在2-DG (2 g/kg BW)给药6小时后的血浆FFA水平 (WT: 生理盐水组n = 4只小鼠,2-DG组n = 5只小鼠;AtglAKO: 生理盐水组n = 6只小鼠,2-DG组n = 5只小鼠)。结果以均值±标准误表示,并使用双尾非配对_t-检验 (b, c (肝脏, iBAT和iWAT), d, f (WT) 和h)、双尾Mann-Whitney检验 (c (gWAT) 和f (AtglLKO)) 以及带Tukey校正的单因素方差分析法 (a) 进行分析。源数值数据和未处理的印迹可在源数据中获得。源数据
**
扩展数据图 3. ATGL 蛋白是…
**
**
扩展数据图 3. ATGL 蛋白在处理过葡萄糖的各种细胞类型中被稳定…
**
扩展数据图 3. ATGL 蛋白在处理过葡萄糖或血清缺乏的各种细胞类型中被稳定。
(a-b) ATGL 转录水平在 HepG2 细胞中在去除葡萄糖或 50 mM 2-DG 处理后 6 小时的定量 (n = 4 个独立实验每组)。(c, d) Atgl 转录水平在 iBAs 中在去除葡萄糖和 100 mM 2-DG 处理后 24 小时的定量 (n = 4 个独立实验每组)。(e) 在 HEK293-AAV 细胞中去除葡萄糖后 6 小时的 ATGL 免疫印迹 (n = 6 个独立实验每组)。(f) 在 HEK293-AAV 细胞中在处理 50 mM 2-DG 后 12 小时的 ATGL 免疫印迹 (n = 5 个独立实验每组)。(g) 在 HEK293T 细胞中去除血清后 6 小时的 ATGL 免疫印迹 (n = 10 个独立实验每组)。(h, i) 在 HEK293T 细胞中在处理氨基酸或脂肪酸自由培养基后 6 小时的 ATGL 免疫印迹 (n = 7 个独立实验每组)。(j) 从 HepG2 细胞中提取的 WCE 和 LD 组分在去除葡萄糖后 6 小时的 ATGL 免疫印迹。三次独立重复,结果相似。(k) 在 HepG2 细胞中处理 DGAT1/2 抑制剂后 48 小时的 LD 代表性图像,并用 BODIPY 染色。比例尺,5 μm。两次独立重复,结果相似。(l, m) 在 HepG2 细胞中去除葡萄糖或 2-DG 处理后 6 小时在没有 LDs 的情况下的 ATGL 免疫印迹 (n = 4 个独立实验每组)。(n) 在 HepG2 细胞中处理 BFA 并用抗 GM130 免疫染色的高尔基体代表性图像。比例尺,20 μm。两次独立重复,结果相似。(o, p) 在 HepG2 细胞中去除葡萄糖或 2-DG 处理后 6 小时在没有高尔基体的情况下的 ATGL 免疫印迹 (n = 4 个独立实验每组)。结果以均值 ± 标准误表示,并使用双尾非配对 t-检验 (a 到 i, l, m, o (DMSO) 和 p) 以及双尾 Mann-Whitney 检验 (o (BFA)) 进行分析。源数值数据和未处理的印迹可在源数据中获得。源数据
**
扩展数据图 4. 高尔基体 PtdIns4P 调节…
**
**
扩展数据图 4. 高尔基体 PtdIns4P 调节高尔基体中 ATGL 蛋白的稳定性.
**
扩展数据图 4. 高尔基体 PtdIns4P 调节高尔基体中 ATGL 蛋白的稳定性。
(a) HEK293-AAV 细胞在葡萄糖剥夺 12 小时后的 P4M-EGFP 信号的代表性图像 (n = 107 细胞每组)。比例尺,5 μm。(b) HEK293-AAV 细胞在葡萄糖剥夺后的 SACM1L-EGFP 信号的代表性图像。比例尺,5 μm。三次独立重复,结果相似。(c) 在葡萄糖剥夺 24 小时后 HEK293T 细胞中总 PtdIns4P 水平的测定 (n = 9 次独立实验每组)。(d) 在 HEK293T 细胞中使用 AMPK 抑制剂化合物 C (Cpd C) 和激活剂 AICAR 处理后的 ATGL 和 pAMPK 的免疫印迹 (n = 4 次独立实验每组)。(e) 在 HEK293-AAV 细胞中通过免疫染色定量 PtdIns4P,处理 Cpd C 和 AICAR 后 (n = 67 细胞每组)。比例尺,5 μm。(f–g) 在 HEK293-AAV 细胞中通过免疫染色定量 PtdIns4P 水平和高尔基体面积,PI4KB 和 SACM1L 敲低 72 小时后 (f 中 n = 103 细胞每组;g 中 n = 130 细胞每组)。比例尺,5 μm。(h) 在 HEK293T 细胞中定量 ATGL 转录本,PI4KB 和 SACM1L 敲低 72 小时后 (n = 4 次独立实验每组)。(i–j) 在 HEK293-AAV 细胞中通过免疫染色定量 PtdIns4P 水平和高尔基体面积,处理 5 μM PIK93、10 μM BF738735 和 10 μM UCB9608 24 小时后 (i 中 n = 136 细胞每组;j 中 n = 100 细胞每组)。比例尺,5 μm。(k) 在 HEK293T 细胞中通过免疫印迹检测在处理 5 μM PIK93、10 μM BF738735 和 10 μM UCB9608 24 小时后异位表达的 ATGL (n = 3 次独立实验每组)。结果以均值 ± 标准误表示,并使用双尾非配对 t ext{-test} (c 和 d (Ctr 和 AICAR))、双尾 Mann-Whitney 检验 (a, d (DMSO 和 Cpd C) 和 e)、单因素方差分析法与 Dunnett 校正进行控制组与其他组之间的多重比较 (h 和 k) 以及 Kruskal-Wallis 检验与 Dunn 校正进行控制组与其他组之间的多重比较 (f, g, i 和 j) 分析。源数值数据和未处理的印迹可在源数据中获得。源数据
**
扩展数据图 5. 葡萄糖缺乏提高…
**
**
扩展数据图 5. 葡萄糖缺乏通过 PtdIns4P 调节提高高尔基体中的 ATGL 蛋白。
**
扩展数据图 5. 葡萄糖缺乏通过 PtdIns4P 调节提高高尔基体中的 ATGL 蛋白。
(a) HepG2细胞中异位表达ATGL的免疫印迹,处理后24小时,使用5 μM PIK93、10 μM BF738735和10 μM UCB9608(每组n = 3个独立实验)。(b) iBAs中_Atgl_转录水平的定量,_Pi4kb_敲低后72小时(每组n = 4个独立实验)。(c) iBAs中_Atgl_转录水平的定量,Sacm1l_敲低后72小时(每组n = 4个独立实验)。(d) HEK293-AAV细胞中SACM1L-EGFP和SACM1LK2A-EGFP的代表性图像。比例尺,5 μm。重复两次,结果相似。(e) HEK293T细胞中ATGL的免疫印迹,在SACM1LK2A-EGFP过表达背景下,处理后6小时使用无葡萄糖培养基(每组n = 6个独立实验)。(f) HEK293T细胞中ATGL的免疫印迹,在UCB9608处理背景下,葡萄糖剥夺后6小时(每组n = 6个独立实验)。结果以均值±标准误表示,并使用双尾非配对_t-检验(e和f)和单因素方差分析法,采用Dunnett校正进行控制组与其他组之间的多重比较(a到c)。源数值数据和未处理的印迹可在源数据中获得。源数据
**
扩展数据图 6. 葡萄糖缺乏减少…
**
**
扩展数据图 6. 葡萄糖缺乏通过高尔基体驻留的 E3 连接酶复合体减少 ATGL 多泛素化…
**
扩展数据图 6. 葡萄糖缺乏通过高尔基体驻留的 E3 连接酶复合体 CUL7FBXW8 降低 ATGL 多泛素化。
(a) HEK293T细胞中ATGL的免疫印迹,处理后12小时,使用10 μM MG132和100 μM氯喹(每组n = 3个独立实验)。(b, c) HEK293T细胞中ATGL-HA和ATGLK0-HA的免疫印迹,经过葡萄糖撤除或50 mM 2-DG处理(每组n = 3个独立实验)。(d, e) HEK293T细胞中转染ATGL–FLAG并用无葡萄糖培养基或2-DG处理后的K48连接多泛素化模式检测,随后进行免疫沉淀以富集ATGL–FLAG。三次独立重复,结果相似。(f, i) HEK293-AAV细胞中GP73的免疫印迹或培养基中分泌的GP73,处理后使用5 μg/mL BFA、5 μM PIK93、10 μM BF738735、10 μM UCB9608或不同的siRNA。两次独立重复,结果相似。(j) 通过免疫印迹对HEK293T WCE中ATGL蛋白水平的定量,在小规模siRNA筛选中(对照组或其他组n = 22或4个独立实验)。(k) HEK293T细胞中ATGL的免疫印迹,在_CUL7_和_FBXW8_敲低后72小时。四次独立重复,结果相似。(l) HEK293T细胞中_ATGL_转录水平的定量,在_CUL7_和_FBXW8_敲低后72小时(每组n = 4个独立实验)。(m) 在存在200 μM油酸的情况下,siRNA敲低后72小时HEK293-AAV细胞中通过BODIPY染色的LDs的代表性图像。比例尺,20 μm。三次独立重复,结果相似。(n) 在_HepG2_细胞中_ATGL_转录水平的定量,在_CUL7_和_FBXW8_敲低后72小时(每组n = 4个独立实验)。(o) 在_iBAs_中_Atgl_转录水平的定量,在_Cul7_和_Fbxw8_敲低后72小时(每组n = 4个独立实验)。结果以均值±标准误表示,并使用双尾非配对_t_-检验(a到c)、单因素方差分析法与Dunnett校正进行对照组与其他组之间的多重比较(j、l和n)以及Kruskal-Wallis检验与Dunn校正进行对照组与其他组之间的多重比较(o)。源数值数据和未处理的印迹可在源数据中获得。源数据
**
扩展数据图 7. FBXW8 的招募…
**
**
扩展数据图 7. 通过与 PtdIns4P 的相互作用招募 FBXW8 到高尔基体。
**
扩展数据图 7. 通过与 PtdIns4P 的相互作用招募 FBXW8 到高尔基体。
(a) 代表性免疫荧光图像显示在处理过无糖培养基的 HEK293-AAV 细胞中的内源性 CUL7。比例尺,5 μm。独立重复三次,结果相似。(b) 代表性免疫荧光图像显示在处理过无糖培养基的 HEK293-AAV 细胞中的内源性 FBXW8(每组 n = 64 个细胞)。比例尺,5 μm。(c) 代表性免疫荧光图像显示在处理过 UCB9608 的 HEK293-AAV 细胞中的内源性 FBXW8(每组 n = 64 个细胞)。比例尺,5 μm。(d) 在稳定表达 FBXW8-FLAG 和 FBXW8 突变体-FLAG 的 HEK293T 细胞中异位表达蛋白的免疫印迹。独立重复两次,结果相似。(e) 与纯化重组蛋白 FBXW8-FLAG 和 FBXW8 突变体-FLAG 共同孵育的膜脂条的印迹分析。独立重复三次,结果相似。结果以均值 ± 标准误表示,并使用双尾非配对 t-检验(b)和双尾 Mann-Whitney 检验(c)进行分析。源数值数据和未处理的印迹可在源数据中获得。源数据
**
扩展数据图 8. ATGL 驱动的调节…
**
**
扩展数据图 8. 通过操控高尔基体调节 ATGL 驱动的脂解和脂肪肝发展…
**
扩展数据图 8. 通过操控高尔基体 PtdIns4P- CUL7FBXW8-ATGL 轴调节 ATGL 驱动的脂解和脂肪肝发展。
(a) Atgl 转录水平在肝脏中来自肝细胞特异性 Pi4kb 敲除小鼠的定量 (n = 8 只小鼠每组)。(b) Atgl 转录在肝脏中来自肝细胞特异性 Cul7 和 Fbxw8 敲除小鼠的定量 (n = 6 只小鼠每组)。(c) 在 AAV8 给药后 4 周,喂养 NCD 的肝细胞特异性 Pi4kb 敲除小鼠的体重 (n = 10 只小鼠每组)。(d) 在 AAV8 给药后 8 周,喂养 HFD 的肝细胞特异性 Pi4kb 敲除小鼠的体重 (n = 5 只小鼠每组)。(e) 在 AAV8 给药后 4 周,喂养 NCD 的肝细胞特异性 Cul7 和 Fbxw8 敲除小鼠的体重 (n = 11 只小鼠每组)。(f) 在 AAV8 给药后 12 周,喂养 HFD 的肝细胞特异性 Cul7 和 Fbxw8 敲除小鼠的体重 (n = 9 只小鼠每组)。(g) 在 UCB9608 治疗期间的体重增加 (n = 10 只小鼠每组)。(h–k) DMSO 和 UCB9608 处理小鼠的脂肪储存和肝脏中 ATGL 蛋白的免疫印迹 (n = 12 只小鼠每组)。(l) 通过 qPCR 定量 DMSO 和 UCB9608 处理小鼠的脂肪储存和肝脏中 Atgl 转录水平 (n = 12 只小鼠每组)。(m–p) 在 HFD 中给药 UCB9608 3 周后,野生型小鼠的能量消耗、呼吸交换比 (RER)、食物摄入和运动活动测量 (n = 6 只小鼠每组)。(q) DMSO 和 UCB9608 处理的野生型 (WT) 和肝脏特异性 Atgl 敲除 (AtglLKO) 小鼠的肝脏 TG 水平 (n = 6 只小鼠每组)。结果以均值 ± 标准误 (除了 d、f 和 g 以均值 ± 标准差表示) 显示,并使用双尾未配对 t-检验 (a, c, d, g (4 和 6 周), h 到 l, 和 q)、双尾 Mann-Whitney 检验 (g (8 周))、协方差分析 (m)、带 Dunnett 校正的单向方差分析方法用于控制组和其他组之间的多重比较 (b, e 和 f) 以及双向方差分析方法 (n-p)。源数值数据和未处理的印迹可在源数据中获得。源数据
**
扩展数据图 9. 小鼠的改善…
**
**
扩展数据图 9. 改善小鼠 MASH 进展和人类肝移植中的脂肪变性…
**
扩展数据图 9. 通过阻断高尔基体 PtdIns4P 生成改善小鼠 MASH 进展和人类肝移植中的脂肪变性。
(a) 使用14C-棕榈酸作为底物测量肝脏脂肪酸氧化 (每组n = 10只小鼠)。(b) 通过切割的Caspase-3抗体对MASH小鼠肝脏凋亡进行免疫组化分析。比例尺,25 μm。每组10只小鼠的代表性图像,结果相似。(c) MASH小鼠脂肪组织中切割Caspase-3的免疫印迹。独立重复两次,结果相似。(d) 在8天灌注期间肝脏移植物的胆汁酸排泄。(e) 在灌注过程中,UCB9608处理的肝脏移植物的氧气消耗率。使用一个肝脏移植物进行灌注。(f) 在透析液中测量NEFA水平。技术上重复三次,结果相似。(g) 从肝脏移植物中进行穿刺活检的时间点和位置。(h, i) 不同时间点从对照移植物中取的人类肝脏活检的ATGL蛋白免疫印迹及TG水平定量。技术上重复三次,结果相似。(j) 不同时间点取的活检的H&E染色。比例尺,50 μm。每个时间点取一块肝脏样本。数据以均值±标准误表示,并使用双尾Mann-Whitney检验(a)和双尾Pearson相关性(i)进行分析。源数值数据和未处理的印迹可在源数据中获得。源数据