. 2016年8月9日;17(8):1107. doi: 10.3390/ijms17081107
γ-谷甾醇 (Orz),一种从米糠层提取的甾醇酯,具有广泛的生物活性。除了其抗氧化活性,Orz 通常与降胆固醇、抗炎、抗癌和抗糖尿病效果相关联。近年来,Orz 的有效性已被研究用于代谢疾病的治疗,因为它能改善胰岛素活性、胆固醇代谢和相关的慢性炎症。先前的研究表明,Orz 通过下调与肥胖(CCAAT/增强子结合蛋白 (C/EBPs))、炎症反应(核因子 kappa-B (NF-κB))和代谢综合症(过氧化物酶体增殖物激活受体 (PPARs))相关的蛋白质编码基因的表达,发挥直接作用。这种广泛的有益活性可能源于其抗氧化特性所触发和/或抑制的复杂相互作用和信号网络。本文综述了 Orz 在代谢紊乱中的重要性,这些紊乱表现出显著的氧化失衡,如葡萄糖代谢障碍、肥胖和炎症。
关键词: γ-谷甾醇, 阿魏酸, 抗氧化能力, 脂质异常, 肥胖, 炎症
谷物是全球最常见的主食。考虑到稻米 (Oryza sativa L.) 是人类饮食中的主要谷物,并且它养活了超过一半的世界人口,因此非常重要的是要考虑其成分,如γ-谷甾醇(Orz)、纤维、γ-氨基丁酸和维生素。因此,必须考虑到所有这些生物活性成分的协同作用,以便评估食用糙米(BR)的益处。强烈建议在日常饮食中食用未精制的糙米,因为获得白米的精制步骤大约减少了94%的谷物Orz含量 [1]。此外,精制过程去除了其他具有抗氧化活性的化合物,如酚类、维生素E和生育酚 [1]。此外,Orz的成分及其含量在不同的稻米品种中是可变的 [2];它在谷物中的分布不均,外层的含量较高,而内核的浓度较低。改善BR生物活性成分的策略包括影响发芽过程。通过诱导整个稻米谷物的发芽,其成分显著增加 [3],而且发芽米的Orz含量略高于BR,这取决于品种 [4]。
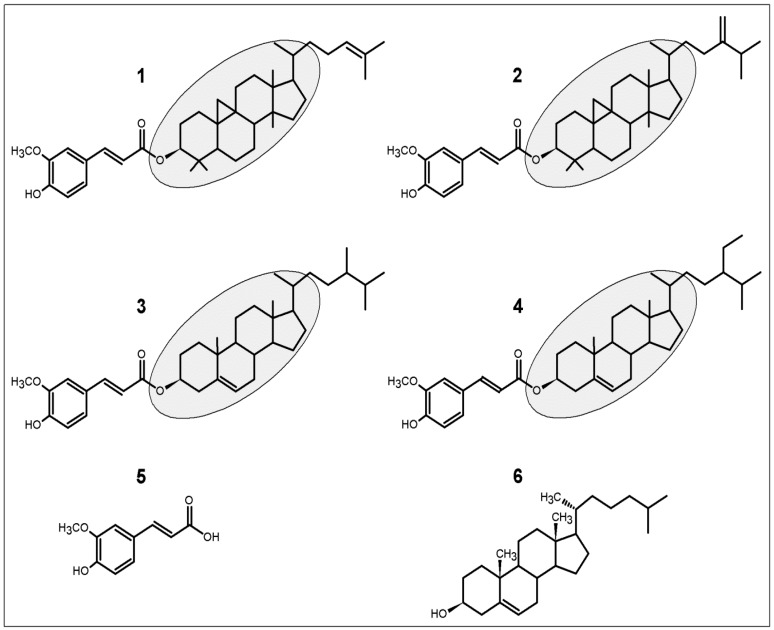
Orz 由阿魏酸 (FA) 酯和植物甾醇(甾醇和三萜醇)混合而成 [5,6]。在 Orz 中至少鉴定出 10 种甾醇阿魏酸酯,如环阿尔特酯、24-亚甲基环阿尔特酯、坎佩斯酯、坎佩斯甾醇阿魏酸酯、斯蒂格马斯酯、坐甾醇阿魏酸酯、∆7-斯蒂格马斯酯、斯蒂格马酯、坎佩斯甾醇阿魏酸酯和坐甾醇阿魏酸酯 [5]。其中,环阿尔特酯、24-亚甲基环阿尔特酯、坎佩斯甾醇和坐甾醇阿魏酸酯占主导地位 (Figure 1)。Orz 成分通常通过高效液相色谱 (HPLC) 进行纯化,而为了鉴定这些成分的异构体或分子变异性,采用了结晶、核磁共振和质谱 (MS) 等方法 [5,7,8,9]。然而,识别和定量 Orz 的最合适方法是与 MS/MS 结合的液相色谱 [8,10]。该方法鉴定出的成分数量较多,表明它更适合在生物组织和体液中识别和定量 Orz。
四种主要γ-谷甾醇(Orz)成分的分子结构 (1–4)。化学结构由阿魏酸和甾醇阿魏酸酯(灰色背景)组成。(1) 环阿魏酸酯;(2) 24-亚甲基环阿魏酸酯;(3) 坎佩斯特甾醇阿魏酸酯;以及 (4) 植甾醇阿魏酸酯。在人体内,Orz 可以代谢为 (5) 阿魏酸,以及与 (6) 胆固醇非常相似的甾醇阿魏酸酯。
为了更好地理解Orz的健康益处背后的机制及其与不同分子的相互作用,有必要考虑其代谢物的分子结构。Orz的消费已被证明是安全的,没有报告相关的副作用。然而,现有的大多数数据来自体外研究或动物模型。在最近的一项研究中,Szcześniak等人回顾了这些研究,并得出结论,Orz的有益效果是由于其抗氧化活性和脂质代谢的改变 [11]。在动物模型中(剂量范围为1–2000 mg/kg体重)或体外(剂量范围为0.1–1000 µmol)使用的特定剂量显著缺乏 [11]。然而,仍然有必要阐明确切的作用机制,并确认在人类研究中获得的结果。例如,在轻度高胆固醇血症的男性中,每天50 mg的Orz剂量持续4周,降低了总胆固醇、低密度脂蛋白(LDL)胆固醇和LDL/高密度脂蛋白(HDL)胆固醇比率,分别降低了6.3%、10.5%和18.9%;而将剂量增加到800 mg/天并未增强降低脂质的效果 [12]。
源自 Orz 的酯化苯甲酸酯与胆固醇有某些相似之处 (图 1)。作为所有哺乳动物细胞的基本组成部分,胆固醇也是髓鞘的重要结构成分,以及氧甾醇、类固醇激素和胆汁酸的前体 \13]。研究表明,Orz 可以降低血浆胆固醇水平和肝脏摄取 \14,[15](#B15-ijms-17-01107)]; 因此,它可以影响人类机体的不同细胞功能。Orz 被归因于多种生物学效应,如抗糖尿病 \16]、抗氧化 \1,[17](#B17-ijms-17-01107)] 和抗炎活性 \18]。然而,直到最近,研究最多的与 Orz 相关的活动包括其降脂和抗肥胖效果 \15,[16](#B16-ijms-17-01107),[19](#B19-ijms-17-01107),[20](#B20-ijms-17-01107)]。这些潜在的健康益处主要通过引入高 BR 或发芽 BR (GBR) 的饮食来验证。此外,不仅 Orz 对这些效果负责,FA(Orz 的主要代谢物)已被证明可以改善脂质代谢、高血压和葡萄糖耐受性 \15,[21](#B21-ijms-17-01107)]。在这里,我们描述了 Orz 的抗氧化活性所带来的广泛有益活动,然后讨论这种化合物如何与多种健康益处相关联。
为了确立Orz在细胞系统抗氧化防御中的有益作用,重要的是要考虑到膳食抗氧化剂对于维持正常细胞功能和确保身体稳态是必不可少的。然而,通过膳食手段调节氧化还原机制目前在人体和食品科学领域正获得相当大的关注。
氧化应激导致一种有害的过程,最终造成细胞结构的损伤,包括膜和脂质,以及蛋白质和DNA [22]。活性氧种(ROS)通过酶促和非酶促反应不断产生。生成ROS的主要酶促反应包括涉及NADPH氧化酶、氮氧化合酶(NOS)、黄嘌呤氧化酶、花生四烯酸以及代谢酶如细胞色素P450酶、环氧合酶和脂氧合酶的反应。ROS的非酶促产生来自线粒体呼吸链。人类体内产生的主要ROS包括单态氧(1O2)、超氧阴离子(O2•−)、羟基自由基(OH•)、过氧化氢(H2O2)和有机过氧化物 [23]。此外,影响氧化平衡的其他分子包括反应性氮种(RNS),如一氧化氮(NO)、亚硝酸盐(NO2−);一氧化碳(CO);硫化氢(H2S)及其阴离子HS− [23]。
氧化失衡导致产生几种反应性分子,这些分子被 Orz 或其代谢物清除。高脂饮食 (HFD) 的消费已被证明会诱导自由基和活性氧 (ROS) 的形成,导致脂质过氧化和氧化应激 [24]。在喂食 HFD 的小鼠中,Orz 和 FA 抑制了脂质过氧化 [14],基于包含每日 15 毫克这两种化合物的饮食,降低了与单独喂食 HFD 的对照小鼠相比,血浆和红细胞的硫代巴比妥酸反应物 (TBARS) [14]。这一发现表明,Orz 和 FA 可以作为 ROS 清除剂,防止脂质过氧化。此外,防止脂质过氧化可以避免脂毒性,这与线粒体功能障碍和细胞 ROS 的形成有关。此外,这些化合物具有降低葡萄糖-6-磷酸脱氢酶 (G6PD) 的能力 [25],这促进了促氧化酶 NAPDH 氧化酶和 NOS 的表达。Orz 的代谢物可以在生物体中诱导不同的抗氧化反应,如在大鼠的血清总抗氧化能力 (TAOC) 和丙二醛 (MDA) 水平中观察到的 [15]。在血清中,HFD 诱导了 TAOC 降低和 MDA 含量增加。然而,与 Orz 相比,FA 处理更好地改善了 TAOC 和 MDA 水平 [15]。
无论使用何种材料(BR、麸皮或分离化合物)来评估稻米的抗氧化能力,将这种潜力严格归因于某一特定的分离化合物是有争议的。酚酸、维生素E、类胡萝卜素和Orz是稻米的典型成分。不同的稻米品种可能含有比维生素E多8-10倍的Orz [2,[17](#B17-ijms-17-01107)],而维生素E被认为是最有效的抗氧化剂之一,因为其生物可利用性。然而,三种主要的Orz代谢物(环阿托品、24-亚甲基环阿托品和甘露醇酯)在与α-和γ-维生素E异构体相比时,对胆固醇氧化的抗氧化活性更高 [17]。其中,24-亚甲基环阿托品酯的抗氧化活性最高,显示出代谢物的抗氧化活性具有变异性 [17]。在另一份报告中,环阿托品、24-亚甲基环阿托品和β-谷甾醇酯,以及FA显示出强大的自由基清除和对脂质过氧化的抗氧化保护,其效果可与α-生育酚相媲美 [26]。酚环上的羟基和ROS诱导的电子离域化是植物甾醇抗氧化活性的重要特征 [17,[27](#B27-ijms-17-01107)]。除了高含量的Orz外,其主要代谢物阿魏酸呈现出CH=CH–COOH基团(肉桂酸),确保了有效的抗氧化活性 [27]。然而,Orz作为抗氧化剂的主要作用可能是由于其防止脂质过氧化和由此产生的氧化应激的能力。因此,与Orz摄入相关的所有潜在健康益处应通过考虑其抗氧化能力和其他代谢相互作用来解读。
在研究与氧化还原失衡相关的氧化应激时,另一个重要的情况是由此导致的线粒体功能障碍。细胞中激活了不同的抗氧化系统,以对抗产生的活性氧(ROS),包括抗氧化分子如超氧化物歧化酶(SOD)、过氧化氢酶 [28],和谷胱甘肽 [29,30]。SOD负责催化O2−的歧化反应,将其转化为H2O2,后者通过过氧化氢酶转化为H2O和O2。谷胱甘肽转移酶是一类超家族蛋白,携带多种氧化还原调节,并存在于所有细胞生命形式中 [31]。这些抗氧化系统的精细调节对于防止线粒体功能障碍至关重要,其失调长期以来被认为与帕金森病(PD)的发病机制有关 [32]。自由基的产生和氧化应激是与神经元线粒体功能障碍相关的有害因素。在一种由罗通农诱导的果蝇模型中,Orz改善了抗氧化防御,防止了氧化应激,并减轻了线粒体功能障碍 [33]。还观察到抗氧化酶(如过氧化氢酶、超氧化物歧化酶和谷胱甘肽-S-转移酶)显著增加,并与消除罗通农产生的有害MDA和ROS相关 [33]。这些活性可能与抑制自由基生成及随之而来的炎症进展的预防有关。
在细胞和分子水平上,氧化应激被认为是胰岛素抵抗、葡萄糖损伤和糖尿病发展的关键因素。许多研究表明,BR 改善了葡萄糖代谢 [20,34,35,36]。然而,当考虑到大米中存在的所有生物活性化合物时,这一说法更为准确。喂食高脂饮食加 BR 的小鼠显示出改善的葡萄糖耐受性和胰岛素抵抗 [35];然而,在同一研究中,Orz 的每日口服剂量产生了与 BR 相同的效果,这表明 Orz 或其代谢物主要负责葡萄糖代谢的调节 [35]。
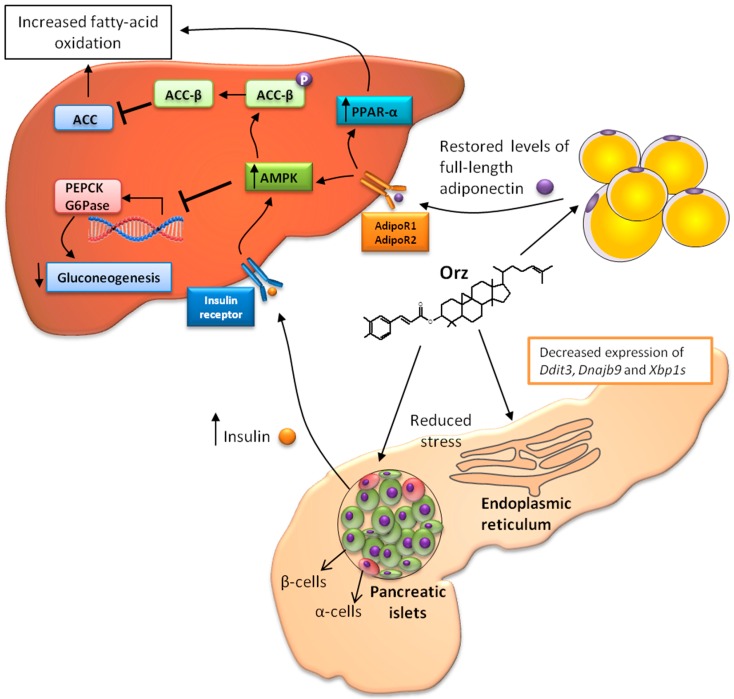
肥胖与胰岛素调节之间存在密切关系。脂肪细胞产生的脂联素已被证明可以调节胰岛素敏感组织(如肝脏和骨骼肌)中的葡萄糖和脂质代谢 [37]。此外,肥胖促进脂肪细胞功能障碍,导致脂联素分泌水平降低 [38]。在一种应激诱导的低脂联素血症模型中,Orz 恢复了球形和全长脂联素水平 [39]。全长脂联素与5′-AMP活化蛋白激酶(AMPK)的磷酸化和激活相关。AMPK 磷酸化通过降低参与糖异生的分子表达水平 [40],如肝细胞中的磷酸烯醇丙酮酸羧激酶(PEPCK)和葡萄糖-6-磷酸酶(G6Pase)来积极调节葡萄糖代谢和胰岛素敏感性 [37]。此外,AMPK 的激活导致辅酶 A 羧化酶(ACC-β)β亚型的磷酸化,从而抑制乙酰辅酶 A 羧化酶(ACC) [37],并因此导致脂肪酸氧化增加(图 2)。
Orz与器官-细胞器的协同作用。内质网(ER)应激导致错误折叠蛋白的积累,并通过凋亡导致胰腺β细胞死亡。Orz降低了ER应激响应基因 Ddit3、Dnajb9 和 Xbp1s 的表达,从而增强了β细胞的胰岛素生产。此外,Orz改善了脂肪细胞对脂联素的生产。胰岛素和脂联素水平的增加可以激活5′-AMP-激活的蛋白激酶(AMPK)(通过AdipoR1),这降低了磷酸烯醇丙酮酸羧激酶(PEPCK)和G6Pase的表达,并抑制了糖异生。此外,AMPK诱导辅酶A羧化酶(ACC-β)的磷酸化,抑制乙酰辅酶A羧化酶(ACC),从而增加脂肪酸氧化。全长脂联素激活过氧化物酶体增殖物激活受体(PPAR-α)(通过AdipoR2),从而刺激脂肪酸氧化并减少组织中的甘油三酯含量。
喂食补充了 Orz 和 FA 饮食的啮齿动物显示出调节的 2 型糖尿病参数,因为它们的空腹血糖水平改善,口服耐受测试中的血糖水平降低 [15]。这些效果可以通过 Son 等人报告的结果来解释,他们显示喂食补充了 0.5% Orz 或 0.5% FA 的高脂饮食 (HFD) 的小鼠血糖水平显著降低,G6Pase 和 PEPCK 活性降低,同时糖原和胰岛素浓度以及葡萄糖激酶活性增加 [25]。胰岛素抑制与糖尿病相关的许多肝脏基因的表达 [41],包括 G6Pase 和 PEPCK。这两个基因对于调节肝脏糖异生至关重要,其抑制代表了 2 型糖尿病控制中的一个重要步骤 [42]。
另一个与2型糖尿病发病机制相关的器官是胰腺。胰腺胰岛细胞中的内质网(ER)压力与逐渐加重的β细胞功能障碍、凋亡和胰岛素抵抗有关 [43]。内质网是细胞器官,其中进行蛋白质合成、折叠和分拣。然而,这个细胞器官中的压力发展是由几种代谢紊乱引起的,结果是错误折叠的蛋白质积累和活性氧(ROS)形成。尽管Orz在胰腺的器官特异性作用仍不清楚,但在口服给药后,Orz在大约1小时内达到其最大血浆浓度。Orz的分布主要发生在大脑,而在胰腺中也发现了相当数量的Orz [44]。在胰腺中,Orz已被证明可以降低ER压力应答基因的表达,如_Ddit3_(CCAAT/增强子结合蛋白同源蛋白)、Dnajb9(内质网驻留DNAJ 4)和X框结合蛋白1的剪接形式(Xbp1s) [44]。这些结果表明,Orz可以防止ER压力诱导的凋亡,从而增强β细胞的胰岛素生产。尽管Orz在脂肪组织中的吸收低于在胰腺中的吸收 [44],但它可能改善前面讨论过的脂联素水平。由于Orz在胰腺中发挥作用(降低ER压力并改善胰岛素分泌)以及在脂肪组织中(改善脂联素水平),因此Orz可能在不同器官中表现出协同效应,特别是在与葡萄糖代谢相关的方面(图2)。改善的脂联素和胰岛素水平最终导致肝脏AMPK的激活。肝脏中的脂联素受体1(AdipoR1)和2(AdipoR2)被全长脂联素刺激,并分别激活AMPK和PPAR-α的磷酸化 [45]。这两条途径可以增加脂肪酸氧化并导致甘油三酯含量减少 [45,46]。AMPK刺激脂肪酸氧化和酮体生成,导致胆固醇合成和脂肪生成的减少。这种激酶可以保护肝脏免受脂质诱导的疾病,从而减少ER压力 [43]。
超重和肥胖(体重指数 ≥ 30 kg/m2)的日益普遍已成为全球性流行病 [47,48]。生活质量的改善和收入的增加导致了营养转型和饮食习惯的变化,例如富含脂肪和糖的食物消费增加,以及营养价值低的食物。这些变化与肥胖及慢性疾病的发展直接相关,如2型糖尿病(T2DM)、心血管疾病、血脂异常和某些癌症 [49]。消费全谷物,如BR,是管理或预防肥胖及相关疾病的一个有前景的方法。这些预防效果大多归因于膳食纤维,因为膳食纤维摄入量高的个体面临较低的肥胖风险,此外,高纤维摄入显著有助于减重 [50]。
与代谢综合征患者的研究表明,食用BR的潜在健康益处是显而易见的 [16]。与食用白米的人相比,BR的消费导致体重、总胆固醇和LDL胆固醇水平下降,以及餐后胰岛素和葡萄糖浓度降低 [16]。然而,米饭中的膳食纤维对总胆固醇、甘油三酯和游离脂肪酸(FFA)血液水平的影响要么很小(或没有) [34,51]。因此,这些效果可能是由Orz和FA促进的,因为它们在喂食富含脂肪和糖的饮食的啮齿动物中显示出体重显著下降 [15,25,35]。高脂饮食的消费与体重增加和局部及全身氧化应激的发展有关。这种情况构成了代谢综合征及相关症状的重要诱因,如高脂血症、高血糖、高血压、胰岛素抵抗和高胰岛素血症 [52,53]。
Orz 的酯化阿魏酸酯表现出抗氧化活性,因为它们从其阿魏酸成分中捐赠氢 [54];这些生物活性化合物的抗氧化能力或通过改善膳食成分的代谢(如胆固醇)可能会带来有益效果。考虑到 FA 是 Orz 的主要代谢产物之一,可以假设其在改善与肥胖相关的症状方面的效果可能通过 Orz 的消费来实现。Wang 等人发现,Orz 和 FA 在缓解高脂饮食和高果糖饮食喂养的老鼠的肥胖和血脂异常方面具有相似的效果。这两种化合物在总胆固醇、甘油三酯和 LDL-胆固醇的血清正常化方面都有效,并且它们诱导了游离脂肪酸(FFA)水平的降低和高密度脂蛋白(HDL)胆固醇的增加 [15]。Rong 等人显示,向高胆固醇饮食中添加 1% 的 Orz 7 周能够使 F1B 金色仓鼠的血浆非 HDL-胆固醇降低 34%。在同一研究中,当 Orz 以 0.5% 添加到高胆固醇饮食中并喂养动物 10 周时,观察到血浆非 HDL-胆固醇减少 57% [55]。
Orz 和 FA 降低甘油三酯和胆固醇水平的能力是通过抑制肝脏脂肪生成直接诱导的,这一过程是通过调节 NADPH 生成酶的活性来实现的 [14]。此外,Orz 和 FA 还能够通过增加粪便脂质排泄来改善血浆和肝脏脂质谱 [14]。现有证据表明,摄入 1.5–2.0 克植物甾醇可能使血液 LDL-胆固醇平均降低 8.5%–10% [56,57]。此外,摄入低饱和脂肪和胆固醇的食物,结合植物甾醇的摄入,可以使 LDL 降低加剧 20% [58]。
值得注意的是,Orz 与胆固醇具有某些分子相似性 (图 1)。因此,考虑植物甾醇通过减少胆固醇胶束化来发挥其降胆固醇作用是相关的。在肠腔内,膳食植物甾醇在胆盐的作用下被溶解在胶束中,然后扩散到肠上皮细胞。植物甾醇的溶解度和对胆盐胶束的亲和力高于胆固醇,因此它们可能有效地置换胶束中的胆固醇 [59]。此外,植物甾醇酯与消化酶相互作用,特别是胰胆固醇酯酶 (PCE)。该酶负责在胶束形成之前水解脂质。与酯类相比,游离植物甾醇对胆固醇酯水解没有影响 [60]。体内游离脂肪酸 (FFA) 的血清可用性对于诱导肝脏脂肪生成至关重要,而 Orz 可能通过降低 FFA 和减少肝脏甘油三酯合成来控制这一机制 [15]。这一结果可能是通过降低肝脏 X 受体 α (LXRα)、脂肪酸合成酶 (FAS) 和硬脂酰辅酶 A 去饱和酶-1 (SCD-1) 的表达获得的 [15]。
人类的无调节食欲主要源于瘦素缺乏 [61]; 瘦素是一种由脂肪细胞分泌的激素,作用于下丘脑的一部分神经元,以调节食物摄入、热生成和血糖水平 [62]。瘦素抑制食物摄入,刺激细胞能量消耗,并导致身体脂肪储存的减少 [62]。然而,Orz 的对比效应及其降低血清瘦素水平或减弱对高脂饮食偏好的能力已被报道 [15,35]。除了在食欲调节中的关键作用外,瘦素抵抗与过度营养和下丘脑内质网应激相关。FFA水平升高和过度营养是导致内质网应激的条件,并触发功能失调的蛋白质折叠 [61]。错误折叠蛋白的细胞内积累导致内质网应激,并引发一个称为未折叠蛋白反应的复杂网络的激活 [63]。这些机制直接参与肥胖、胰岛素抵抗和2型糖尿病 [63]。然而,内质网应激的逆转及其相关的蛋白质折叠过程的改善导致胰岛素敏感性增加,并使肥胖小鼠的2型糖尿病得到逆转 [64]。Kozuka 等人(2012)发现 Orz 减轻了内质网应激,改善了葡萄糖代谢,并降低了血浆瘦素。此外,作者观察到对膳食脂肪的偏好减弱,以及以下内质网应激反应基因的表达降低:CCAAT/增强子结合蛋白同源蛋白 (Chop)、内质网驻留 DNAJ 4 (ERdj4) 和 X-box 结合蛋白 1 的剪接形式 (Xbp1s) [35]。
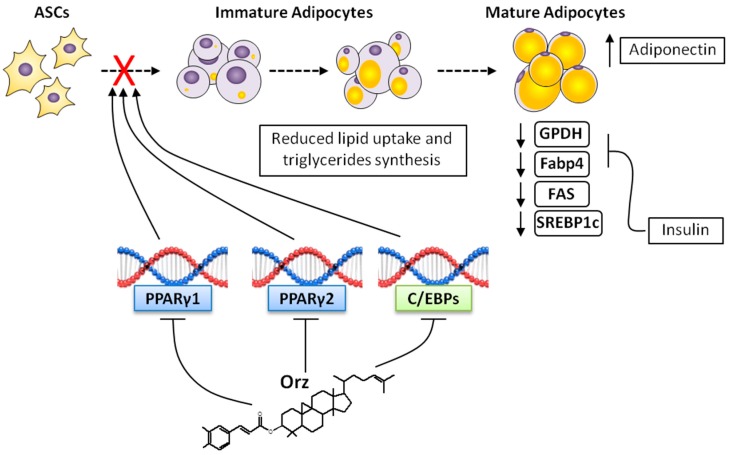
脂肪生成受到多种转录因子的调控,这些因子协调无数蛋白质反应,并最终导致前脂肪细胞向脂肪细胞的分化 [65]。在脂肪细胞中表达的转录因子中,CCAAT增强子结合蛋白(C/EBPs)和PPARγ是这一过程中的关键因子,它们的调控可能会阻止脂肪生成所需的复杂转录级联反应和蛋白质激活 [66]。PPARγ对脂肪细胞分化的必要性超过了任何其他转录因子 [67]。PPARγ的两个亚型(PPARγ1和PPARγ2)由同一个基因产生;然而,PPARγ1在多个组织中表达,而PPARγ2的表达几乎仅限于脂肪组织。即使在PPARγ2敲除小鼠中,也观察到PPARγ1的补偿效应 [68]。此外,抑制PPARγ1会阻止脂肪细胞的成熟(肥大)和C/EBPα的表达 [69],这表明PPARγ对脂肪细胞脂质积累至关重要(图3)。除了对分化的直接影响外,PPARγ和C/EBPα还可以被C/EBP-β和C/EBP-δ刺激,这些因子在分化的早期阶段表达 [65]。
脂肪细胞分化的步骤及Orz的可能影响。脂肪组织干细胞(ASCs)通过复杂的信号网络被诱导分化为成熟脂肪细胞。PPARγ和C/EBPα是这一分化的主要调节因子。通过阻断PPARγ和C/EBPs的表达,Orz对脂肪细胞分化产生直接影响。未成熟脂肪细胞需要脂质摄取,而Orz降低了甘油-3-磷酸脱氢酶(GPDH)、脂肪酸合成酶(FAS)、脂肪酸结合蛋白4(Fabp4)和类固醇调节元件结合蛋白-1c(SREBP-1c)的活性。这个复杂的网络可能与全身性降低的胰岛素抵抗相关,以及改善的内质网应激和提高的脂联素分泌,这些都是由Orz及其代谢物诱导的。
在平行通路中存在的其他因素参与了PPAR-γ和C/EBPs的调节,例如甾醇调节元件结合蛋白-1c (SREBP-1c)。此外,SREBP-1c是脂肪生成酶(如ACC和FAS)的重要调节因子,它通过诱导内源性配体来控制PPARγ的表达 [70]。胰岛素刺激3T3-L1前脂肪细胞显著增强SREBP-1c的表达 [70],而且,显性负SREBP-1c的异位表达已被证明通过调节参与胆固醇稳态、脂肪酸合成和甘油脂合成的关键酶的基因来抑制分化 [71]。Ho等人显示,GBR或BR的提取物下调了C/EBP-β、C/EBP-α、PPARγ和SREBP-1c的表达 [19]。这些数据表明,BR中存在的生物活性化合物可以控制脂肪细胞的分化。然而,提取物中存在哪些化合物,以及哪些化合物导致抗脂肪生成效应,尚未明确。相反,Jung等人显示,Orz通过刺激PPAR-γ和C/EBPα蛋白表达诱导3T3-L1细胞分化为脂肪细胞 [72]。同一研究中提出的结果表明,前脂肪细胞向脂肪细胞的分化是由Orz诱导的,并依赖于哺乳动物雷帕霉素靶蛋白复合体1 (mTORC1),而mTORC1又可以激活PPAR-γ [72]。Orz在脂肪细胞分化中的确切参与尚未完全解释;然而,这一过程似乎与ROS的产生严格相关 [53],并且可以通过直接抑制转录因子和/或ROS清除诱导有效的作用机制。
与脂肪细胞成熟(肥大)相关的重要分子是甘油-3-磷酸脱氢酶(GPDH) [73] 和脂肪酸结合蛋白4(FABP4/aP2) [74]。脂肪组织中GPDH的升高与三酰甘油的合成增加有关 [75]。然而,用于甘油3-磷酸酯化的脂肪酸必须来自循环脂蛋白和/或食物 [75]。GBR提取物与3T3-L1细胞中GPDH活性的降低相关 [19]。通过阻断PPARγ和C/EBPs的表达,或通过降低GPDH活性,Orz能够直接影响脂质积累和脂肪量扩展,这些都是脂肪细胞肥大的特征(图3)。FABP4不断从脂肪细胞释放,并在脂肪酸摄取中发挥关键作用。胰岛素分泌抑制FABP4释放;然后它协调脂肪细胞成熟期间的脂质积累 [74]。FAS是一种同源二聚体酶,负责内源性脂肪酸的合成,在体重和肥胖的调节中发挥核心作用 [76]。在正常情况下,FAS将多余的碳水化合物转化为脂肪酸,然后将其酯化为储存的三酰甘油。然而,在癌症 [77] 和肥胖 [76] 等代谢紊乱的情况下,FAS可能会出现失调水平。脂肪组织中FAS表达的增加与能量摄入的增加相关 [76]。在3T3-L1细胞分化为脂肪细胞的过程中,GBR和可能的Orz通过降低_FAS_的mRNA表达显示出有趣的抗脂肪生成活性 [19]。
在文献中,几乎没有文章单独研究Orz或其代谢物的抗肥胖效果。然而,应用GBR和/或BR提取物来评估这一效果,可以推断出一些对Orz的影响,特别是因为这种化合物无疑是区分那些归因于大米的健康益处与其他谷物中未发现的益处的关键。
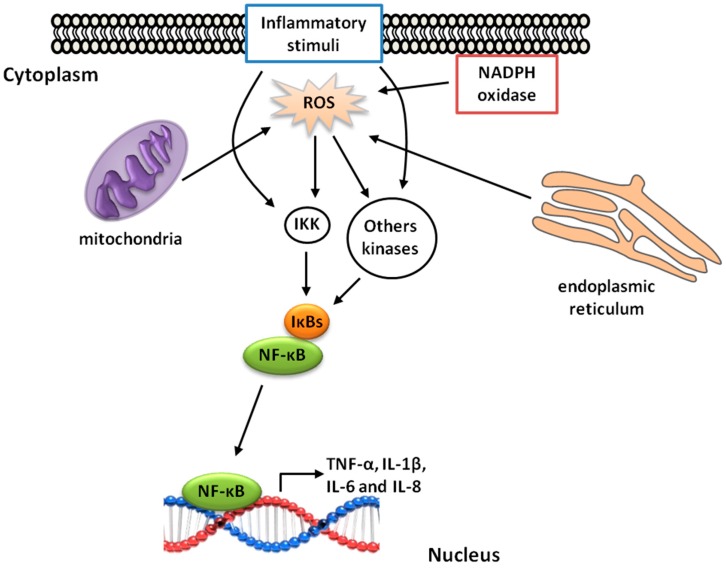
Orz 组件可能有助于防止过敏反应中的炎症过程的发生,因为环烯醇酯的非极性结构被证明能够捕获免疫球蛋白 E 并抑制肥大细胞脱颗粒介导的过敏反应 [78]。由于其抗炎和抗氧化活性,Orz 被认为具有多种健康益处。炎症的存在增加了细胞内活性氧 (ROS) 的产生,既可以通过 NADPH 氧化酶,也可以通过线粒体电子传递链 [79]。这些反应性分子与炎症过程的进展直接相关,因为它们会引起细胞损伤和/或导致氧化还原敏感转录因子的激活 (Figure 4)。一些来自质膜或细胞器膜的 ROS 可以通过调节转录因子的磷酸化来影响转录,而来自核周线粒体或核黄酶的 ROS 可以通过直接靶向 DNA 参与转录控制 [23]。此外,炎症还可以通过内质网折叠过程(产生 ROS)或通过该过程的中断加剧,导致未折叠蛋白释放和细胞损伤 [80]。
ROS介导的核因子κB (NF-κB) 激活的信号机制。炎症刺激(促炎细胞因子、氧化应激等)以及线粒体、NADPH氧化酶和内质网产生的ROS触发这些激酶通路,导致NF-κB激活。NF-κB随后可以转位到细胞核并诱导靶基因转录,如TNF-α、IL-1β、IL-6和IL-8。Orz可以通过清除ROS来减少炎症,从而抑制NF-κB通路。
在转录因子中,核因子-kappa B (NF-κB) 参与调节促炎基因,这代表了产生促炎细胞因子如肿瘤坏死因子-α (TNF-α)、IL-1β、IL-6 和 IL-8 的关键步骤 [81]。Orz 在调节这些细胞因子中的作用在结肠炎的实验模型中得到了验证。观察到接受 Orz 处理的小鼠中 TNF-α、IL-1β、IL-6 和环氧合酶-2 的 mRNA 表达显著降低。同一作者描述了炎症细胞的组织浸润减少 [18]。
NF-κB 是 Rel 蛋白家族的一个成员,可以形成同源二聚体或异源二聚体。NF-κB 的活性受到抑制性 IκB 蛋白的调节 [81]。炎症或氧化还原细胞刺激诱导 IκB 激酶 (IKK) 通路,并导致一系列激活,如 MAP 激酶、c-Jun 氨基末端激酶 (JNK) 和 TNF 受体相关因子 1 (TRAF1) 和 2 (TRAF2) [82]。在刺激细胞中,NF-κB 被困在细胞质中,并在存在包括氧化应激的刺激后转移到细胞核中 [82]。有趣的是,Islam 等人 (2009) 报告称,Orz 的植物甾醇酯能够抑制 LPS 刺激的 RAW 264.7 巨噬细胞中 NF-κB 的核转位。Orz 或其代谢物抑制 NF-κB 活性的确切机制仍不清楚;然而,这种抑制似乎是通过清除 ROS 或阻断激活转录因子的分子(如 TNF-α、IL-1β、IL-6 和环氧合酶-2)来诱导的 (Figure 4).
Orz 在预防与氧化应激和高脂肪摄入相关的一些生活方式疾病中发挥着重要作用,至少在某种程度上。在将某些器官特定的效应归因于 Orz 之前,有必要考虑其在细胞中的可变摄取,以及其与转录因子、活性氧(ROS)和参与特定健康障碍的蛋白质/酶的相互作用。Orz 的自由基清除能力触发了一系列复杂的相互作用,并最终导致器官-细胞特定的反应。这些相互作用与减少涉及内质网应激、脂质摄取和过氧化的过程,以及与改善葡萄糖代谢相关的过程有关。Orz 作为一种功能性食品引起了人们的关注,具有多种对生物体有益的相互作用,特别是考虑到其抗氧化、抗肥胖和抗炎特性,以及改善胰岛素抵抗和肝脏代谢的能力。所有这些疾病都表现出特征性的氧化还原失衡。然而,显然需要更多的研究来认识当 Orz 及其代谢物与器官或细胞发生关联时,它们是如何被需要(和使用)的。
本手稿的英语编辑由 Journal Prep 提供。作者衷心感谢“国家科学与技术发展委员会”(CNPq)的财政支持(项目编号:478372/2013-2;305177/2015-0)。
伊戈尔·奥塔维奥·米纳特尔和朱塞皮娜·帕切·佩雷拉·利马决定了主题,分析了文献,设计并撰写了手稿。伊戈尔·奥塔维奥·米纳特尔创建了图表。法比安娜·瓦伦蒂尼·弗朗西斯奎提和卡米拉·雷纳塔·科雷亚帮助撰写和修订了手稿。
作者声明没有利益冲突。
来自国际分子科学杂志的文章在此由 多学科数字出版机构 (MDPI) 提供