. 2022年3月25日;14(4):677. doi: 10.3390/v14040677
副黏病毒属,属于副黏病毒科,已在鸟类(禽副黏病毒;AMPV)和人类(人副黏病毒;HMPV)中被识别。AMPV和HMPV是密切相关的病毒,具有相似的基因组结构,分别引起鸟类和人类的呼吸道疾病。AMPV可分为四个亚组,A-D,是火鸡鼻气管炎和鸡只头部肿胀综合症的病因。流行病学研究表明,AMPV也在野生鸟类中传播,这些鸟类可能作为新亚型的储存宿主。HMPV于2001年首次被发现,但回顾性研究表明,HMPV在人体中至少已传播了50年。AMPV亚组C与HMPV的关系比与其他任何AMPV亚组更为密切,这表明HMPV是在动物间传播后从AMPV-C演变而来的。在本综述中,我们提供了关于副黏病毒发现的历史视角,并讨论了不同AMPV和HMPV亚组的宿主嗜性、致病性和分子特征,以增强对HMPV作为季节性地方性人类呼吸病毒出现的进化路径的理解。
关键词: 鸟类副呼吸道病毒, 人类副呼吸道病毒, 宿主嗜性, 病毒进化, 动物模型, F 蛋白, G 蛋白
由 SARS-CoV-2 大流行引发的全球健康危机无疑提醒我们,新出现的动物源性呼吸病毒对天真的人类群体可能产生的影响。尽管 SARS-CoV-2 的起源尚待确定 [1],但其进化祖先很可能存在于一种蝙蝠宿主中 [2,3]。从未来的角度来看,一个关键问题是 SARS-CoV-2 将在多长时间内以及对社会产生何种影响继续在人类群体中表现出来 [4,5]。在过去一个世纪中,导致以往大流行的流感病毒已经作为季节性呼吸病毒循环了几十年 [6]。在这种背景下,考虑人类冠状病毒 OC43 的假设大流行和牛源起源是有趣的,这是一种与 SARS-CoV-2 相关的 β 冠状病毒,目前主要在高风险群体中引起中等程度的季节性呼吸感染 [7]。这引发了对 SARS-CoV-2 也可能成为一种季节性呼吸病毒的推测,其发病率和死亡率较低,尽管何时会发生这一点是无法预测的 [8]。同样,大多数对人类健康和社会产生重大影响的地方性人类呼吸病毒的起源最终可以追溯到过去的动物源性事件 [9]。对密切相关动物病毒的识别已经阐明了几种通过呼吸途径传播的人类病毒的进化起源,包括流感、麻疹、腮腺炎和风疹病毒 [10,11,12,13]。
人类副黏病毒(HMPV)也被认为是在未知鸟类宿主物种的动物源病毒感染后进化而来的,因为该病毒与鸟类副黏病毒亚型C(AMPV-C)有共同的祖先 [14]。使用贝叶斯系统发育分析副黏病毒序列表明,来自鸟类宿主的溢出事件可能发生在大约200年前 [15]。然而,这留下了许多未解之谜,包括中间宿主物种的可能性、哪些分子决定因素影响了病毒对人类宿主的适应,以及为什么在日益扩展的宏基因组学研究中,没有在其他任何哺乳动物物种中发现副黏病毒。近年来,我们对HMPV感染造成的全球疾病负担的理解有所改善,报告显示五岁以下儿童与HMPV相关的住院年发生率为每千人1例 [16]。此外,PERCH研究记录了在非洲和亚洲七个国家住院儿童中严重肺炎的最常见原因,报告显示病毒(61%)是最常见的原因 [17]。在所有地点、年龄组和严重程度的累积统计中,HMPV在导致严重儿童肺炎的原因中排名第三(7.5%),仅次于呼吸道合胞病毒(RSV)(31.1%)和鼻病毒(7.5%) [17]。在本次综述中,我们讨论了关于鸟类和人类副黏病毒的发现、进化、关键分子决定因素和宿主范围的当前知识。总体而言,这一分析为之前和假设的动物副黏病毒跨物种感染提供了背景。
在1970年代,针对商业火鸡雏鸟(Meleagris gallopavo)中一种众所周知的疾病综合症“急性呼吸疾病综合症”,或更常被称为“火鸡鼻气管炎(TRT)”的病因起源进行了深入的研究 [18,19]。这种高度传染性的疾病除了使用抗生素来限制继发性细菌感染外,几乎没有治疗选择。几种细菌和病毒病原体与火鸡的这种疾病综合症有关,包括 Alcaligenes faecalis [20,21],Bordetella avium [22],Escherichia coli [23],腺病毒 [24],冠状病毒 [23,25],以及传染性法氏囊病毒 [26]。然而,主要的病因学因子在1978年在南非被确认是病毒来源,最初被称为“火鸡鼻气管炎病毒”(TRTV) [27]。病毒颗粒被发现呈多形状,大小从40 nm到500 nm不等,包括球形和丝状形式,具有相对较长、间隔均匀的细表面突起 [19,28]。未分类的TRTV的核衣壳直径约为14 nm,螺旋间距为6.5 nm,类似于RSV的相应结构,而不是其他副粘病毒 [28,29]。对TRTV感染细胞中产生的结构蛋白的分析显示与RSV和小鼠肺病毒(PVM)之间存在密切关系,进一步加强了这一新发现的病毒是第一种在鸟类中识别的肺病毒的假设 [28,30,31]。
在南非火鸡农场首次发现的新型肺病毒,随后也在西欧、亚洲和南美的农场中被发现 [32,33,34,35]。在病毒分离和体内感染研究后确认科赫法则,提供了确凿的证据,证明这种新型病毒是 TRT 的病因 [36,37]。很快发现,鸡 (Gallus domesticus) 也对这种新识别的病毒敏感 [38,39]。尽管呼吸道症状通常较轻,但观察到的眼眶下窦肿胀,这是鸡 TRT 的一个特征性病理标志,导致该疾病综合症更常被称为“肿头综合症”,尽管这一特征并不是鸡该疾病的特征性标志。 TRT 的火鸡和鸡的产蛋量显著下降,因此对家禽业构成了重大威胁 [40]。随着认识到这种疾病也发生在鸡身上,以及在病毒感染的火鸡中观察到的禽类鼻气管炎与其他呼吸综合症在临床上无明显区别,“火鸡鼻气管炎病毒”这一名称迅速变得过时。这共同导致了“禽类肺病毒”(APV)这一名称的更常用 [41,42]。
早期使用多克隆血清进行的研究报告了广泛的交叉中和,因此没有揭示APV株之间的任何抗原差异 [43,44]。直到1990年代,随着新分子和血清学技术的引入,才识别出株间差异:单克隆抗体检测使得在1993年能够区分出两种不同的APV亚型,发现1978年南非原始株与1985年在英国分离的株关系更密切,而与其他在英国和法国分离的株关系较远 [36,45]。第二个独立小组使用不同的单克隆抗体和APV株报告了类似的结果,将在意大利、匈牙利和西班牙分离的株归为一组,并将其与其他英国株区分开来 [41]。此外,在1994年,Juhasz及其同事比较了五种不同APV株的附着基因(G)的核苷酸和预测氨基酸序列,这也表明至少存在两个不同的亚群。英国和法国的分离株形成了第一个亚群A,而西班牙、匈牙利和意大利的株形成了第二个亚群B [46]。因此,这两个亚群被提议命名为亚型A和B,按照标准的RSV命名法 [46]。
1996年在美国科罗拉多州分离出一种新亚型AMPV-C \[47,48]. 该病毒在一个商业火鸡农场被发现,尽管在科罗拉多州似乎很快被根除 \[47],但它很快传播到包括明尼苏达州、北达科他州、南达科他州、爱荷华州和威斯康星州在内的许多其他州 \[49,50]. 该亚型后来在世界其他地区被检测到,1999年在法国从一只穆斯科维鸭 (Cairina moschata) 中获得了病毒分离物或RT-PCR阳性样本 \[51],2005年在韩国的一个活鸟市场从雉鸡中获得 \[52],以及在中国的穆斯科维鸭和鸡中 \[53,54]. 一项全基因组序列的系统发育研究表明,欧亚AMPV-C谱系与美国的AMPV-C谱系形成了自己的支系,尽管尚不清楚这是否由于地理距离或宿主嗜性 \[55]. 另一种亚型AMPV-D于1985年在法国的火鸡群中分离,与其他禽类肺病毒株在抗原和分子上存在差异。自1985年以来未检测到AMPV亚型D,因此可以推测它代表了存在于未识别的野生鸟类储存宿主物种中的一种不同亚型的溢出 \[55,56,57].
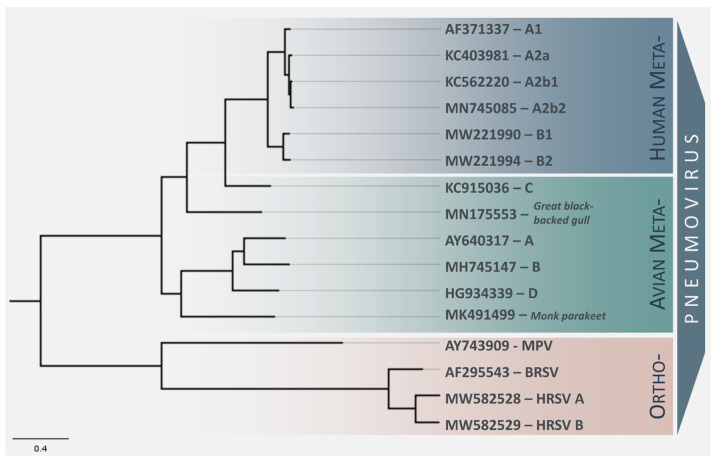
近年来对通过宏基因组学进行病毒监测研究的关注增加,导致发现了两种新的AMPV亚型,在副呼吸道病毒的系统发育树中形成了不同的谱系 (图 1)。2019年在一只僧鹦鹉 (Myiopsitta monachus) 中发现的AMPV株与所有其他已识别的亚型有如此大的差异,以至于它很可能会被分配到自己的亚型 \58\]。2019年在一只大黑背鸥 (Larus marinus) 中也发现了第二种未分类的AMPV亚型,它介于AMPV-C和其他AMPVs之间 \59\]。这两种新型株尚未被国际病毒分类委员会(ICTV)分类,但可能会被命名为AMPV-E和-F。
最大似然法构建的副呼吸道病毒序列的系统发育树。该系统发育树是使用来自NCBI GenBank的完整基因组序列构建的,代表了AMPV和HMPV的不同亚组,正呼吸道病毒序列被用作外群。最大似然法系统发育是使用GTR + G核苷酸替代模型进行的。该树是通过1000次重复的自助法支持生成的。树的末端标签代表各病毒株的NCBI GenBank登录号,比例尺与每个位点的核苷酸替代次数成正比。
在发现AMPV后,经过23年,Metapneumovirus属的第二个成员HMPV才被发现。2001年,一个荷兰团队对28名流行病学上无关的儿童的临床样本进行了病毒分离,这些样本是在20年的时间跨度内收集的 [14]。这些儿童年龄在0至5岁之间,均表现出呼吸道感染(RTI)的共同特征,提示RSV感染,而RTI的最常见原因通过PCR检测被排除。HMPV在细胞培养中的独特生长表型提供了初步数据,表明已分离出一种新型呼吸病毒。在三级猴肾(tMK)细胞中,病毒生长非常缓慢,仅在向细胞培养基中添加外源性胰蛋白酶后,在Vero和A549细胞中观察到 [14]。观察到的细胞病理效应(CPE)在接种后10至14天出现,类似于RSV感染,表现为大合胞体形成,伴随多核细胞的突然内部破坏导致脱落。病毒分离物能够在幼年恒河猴中引起呼吸道感染,并且可以从感染动物中恢复,从而满足科赫法则 [14]。使用一种称为随机任意引物PCR(RAP-PCR)的分子技术,识别出独特的基因序列,系统发育分析显示新病原体与禽类肺病毒最为接近 [14]。同一研究表明,发现的HMPV在2001年首次分离之前,已经在人类中传播了更长的时间。对血清学数据的回顾性分析表明,这种病毒在被发现之前已经在人类中传播了超过半个世纪,几乎所有儿童在五岁时都被感染 [14,60,61]。在完成这种新型metapneumovirus的全基因组序列后,显然它与禽类肺病毒在遗传上相关,特别是与C亚型的关系,氨基酸(aa)同一性约为80%。然而,编码小疏水性(SH)和附着糖蛋白(G)的两个HMPV基因与AMPV亚型的氨基序列同一性较低 [14]。
自2001年在荷兰发现HMPV以来,全球其他研究小组也在临床样本中报告了该病毒的存在,包括北美、澳大利亚和欧洲 [62,63,64,65,66]。通过对核衣壳(N)和附着糖蛋白(G)基因序列的系统发育分析进行的遗传亚型划分显示,病毒株形成了两个不同的谱系,每个谱系包含两个亚组 [67,68,69]。ICTV后来将HMPV的遗传谱系指定为A1、A2、B1和B2,这些谱系分为两个抗原亚型A和B [70]。据估计,HMPV-A和HMPV-B谱系的最近共同祖先可追溯到1964年和1970年 [15]。最近的研究进一步将亚型划分为五个基因型:A1、A2a、A2b、B1和B2,主要基于G基因中的核苷酸变异,这是HMPV株之间序列同一性最可变的基因 [68,71,72]。最近出现了携带G基因中111个核苷酸(nt)或180 nt重复的新的变异体(G-dup),形成了一个新的谱系,称为A2b1和A2b2(或A2c) [73,74]。然而,最近对全基因组HMPV序列的系统发育分析显示了一个独立的命名法,表明A2b2和A2c是同一亚型,这意味着ICTV需要对命名法进行新的评估 [75]。G-dup变异体(A2b)被认为在全球住院患者中成为最主要的变异体,首次在西班牙被发现,随后在日本、克罗地亚和中国被检测到,这表明这些新变异体可能成为全球主要变异体 [73,74,76,77,78,79]。虽然没有观察到临床症状的差异,但可以推测变异体A2b株显示出更高的病毒传播率 [80]。在最近的分子监测研究中未检测到亚型A1,这表明该亚型已被其他亚型的株所取代,特别是快速进化的A2b和A2c谱系的株 [81,82]。
Metapneumoviruses 最初由 ICTV 分配到 Paramyxoviridae 科的 Pneumovirinae 亚科,但这一分类评估在 2016 年进行了修订,AMPV 和 HMPV 被重新分类为新创建的 Pneumoviridae 科中的 Metapneumovirus 属的成员,属于 Mononegavirales 目 [83]。在较旧和较新的分类体系中,metapneumoviruses 与正肺病毒(如 RSV)构成了一个独立的属,因为缺乏非结构蛋白 NS1 和 NS2 以及不同的基因顺序 [83]。根据 ICTV 的说法,特定 metapneumovirus 物种的划分标准是基于病毒的宿主,而不是进化分歧,metapneumovirus 亚群则通过抗原性和序列相关性进行区分。这在 metapneumovirus 的系统发育中得到了反映,因为 AMPV-C 和 HMPV 形成了与 AMPV 亚型-A、-B 和 -D 相比的独特分支,表明 AMPV-C 和 HMPV 共享一个共同的祖先,推测为鸟类来源 (Figure 1) [15]。重要的是要注意,序列和抗原性相关性并不能始终区分 HMPV 和 AMPV。迄今为止,ICTV 尚未根据进化距离定义物种划分的截止点。Brown 和同事提议将 metapneumoviruses 的分类更改为 I 型(HMPV 和 AMPV-C)和 II 型(AMPV-A、-B 和 -D)metapneumovirus [55]。尽管尚未被 ICTV 正式分类,但在 2019 年检测到的新型 Gull Metapneumovirus 与 AMPV-C 和 HMPV 共享一个祖先(“I 型”)。与此相反,在一只僧鹦鹉中检测到的 metapneumovirus 与 AMPV-A、-B 和 -D(II 型)形成了一个独立的分支。我们预计随着在 Metapneumovirus 属中发现更多新亚型,metapneumoviruses 的分类将继续发展。
属于Metapneumovirus的成员具有非分段的负极性RNA基因组,并且在3′-N-P-M-F-M2-SH-G-L的顺序中拥有八个基因,编码九种蛋白质,因为M2基因包含两个开放阅读框,分别编码M2-1和M2-2蛋白 [14,84]。核蛋白(N)包裹病毒RNA,并与磷蛋白(P)和大聚合酶蛋白(L)一起形成核糖核蛋白复合物,介导病毒的复制和转录。基质蛋白(M)有助于病毒的组装和出芽。M2-1和M2-2蛋白调节病毒的复制和转录 [85,86]。Metapneumovirus具有三种膜糖蛋白:附着糖蛋白(G)、小疏水蛋白(SH)和融合(F)蛋白。这些病毒蛋白可能作为宿主特异性的分子决定因素,因为它们在病毒进入和细胞间传播中发挥着关键作用。
人类副流感病毒 G 蛋白是一种高度糖基化的粘蛋白样 II 型膜糖蛋白,由跨膜结构域和外部结构域组成。尽管人类副流感病毒 G 蛋白的作用尚不清楚,但推测它在病毒附着于宿主细胞和对抗宿主的先天免疫反应中发挥作用 [87,88]。然而,与副黏病毒的附着蛋白相比,从重组副流感病毒 1 型在仓鼠模型中表达的 HMPV G 蛋白并未诱导保护性中和抗体 [89]。G 蛋白功能的阐明依赖于体外模型系统的选择。缺乏 G 蛋白的重组 HMPV (rHMPV-delta G) 在 LLC-MK2 细胞中的生长动力学与未修饰病毒相同,表明 G 蛋白对病毒在转化细胞中的进入和传播并非必需 [90]。然而,这些病毒在仓鼠和非洲绿猴模型中被证明是减毒的 [90,91]。对缺乏 G 蛋白的 AMPV-C (rAMPV/CO-deltaG) 进行的类似研究也报告了病毒在体外生长没有障碍,但该病毒在火鸡模型中被发现是减毒的 [92]。研究 AMPV 和 HMPV 的进化动态的研究表明,G 基因的替代率 (每年每位点 3.5 × 10−3 核苷酸替代) 高于 N 基因 (每年每位点 9 × 10−4 核苷酸替代) 或 F 基因 (每年每位点 7.1 × 10−4 到 8.5 × 10−4 核苷酸替代) [4,93]。G 蛋白还显示出最高水平的株间多样性,HMPV 亚组之间的平均氨基酸同一性仅为 63% [94]。在 AMPV 亚组的 G 蛋白之间,明显存在更高水平的差异,最多只有 31.2% 的氨基酸是同源的,细胞质外结构域中存在最高水平的多样性 [57]。
HMPV G 蛋白的长度为 217 到 241 aa 长 (表 1) [94],但近年来出现了新的毒株,这些毒株在 G 开放阅读框内有 111 nt 或 180 nt 的重复 [73,74]。这些毒株通常被称为 A2b 亚组的变异成员。这些重复序列对病毒表型的影响仍然不太清楚。然而,变异 A2b 毒株的快速全球传播表明传播率增加,从而为这些新兴变异体提供了进化优势。Piñana 和同事的一项最新研究假设,含有重复序列的 HMPV G 蛋白可能通过增强 F 蛋白的突出水平来促进免疫逃逸,从而充当免疫监视的屏障 [80]。在 HRSV 中也描述了类似现象,其中在 BA 和 ON1 系系的 G ORF 的第二个超可变区域中分别注意到 60 bp 和 72 bp 的重复序列 [95,96]。这些系现在已在全球范围内占主导地位,再次表明 G ORF 中的这种重复序列赋予了固有的传播优势。
副黏病毒糖蛋白的核苷酸 (nt) 和氨基酸 (aa) 长度。
病毒
子类型
应变
接收编号
宿主物种
F
SH
G
nt
aa
nt
aa
nt
aa
HMPV
A1
NL/00/1
人类
1620
539
552
183
711
236
A2a
HMPV/AUS/146892777/2003/A
人类
1620
539
540
179
660
219
A2b1
HMPV/美国/C1-718/2005/A
人类
1620
539
558
185
687
228
A2b2
bj0077
人类
1620
539
558
185
765
254
B1
B/NSW/WM2170539/17
人类
1620
539
534
177
726
241
B2
B/NSW/WM0025022/20
人类
1623
540
534
177
717
238
A1
NL/00/1
人类
1620
539
552
183
711
236
AMPV
C
GDY
鸭子 1
1614
537
528
175
1758
585
C
15a
鹅 2
1614
537
528
175
1758
585
C
PL-1
雉鸡
1614
537
528
175
795
264
C
科罗拉多
土耳其
1614
537
528
175
1758
585
C
科罗拉多 (截断 G)
土耳其
1614
537
528
175
759
252
(F)
GuMPV_B29
海鸥 3
1617
538
687
228
1641
546
A
LAH A
疫苗
1617
538
528
175
1176
391
B
LN16
鸡肉
1617
538
528
175
1245
414
D
土耳其/1985/Fr85.1
土耳其
1617
538
528
175
1170
389
(E)
PAR-05
鹦鹉 4
1620
539
522
173
1323
439
AMPV 病毒株也被证明含有不同长度的 G 蛋白。AMPV-A、-B 和 -D 的 G ORF 大小分别为 1176 nt (391 aa)、1245 nt (414 aa) 和 1170 nt (389 aa) (Table 1) [55]。G 蛋白的长度在属于 AMPV-C 亚组的病毒株之间也被报道为可变 [55,97,98,99]。值得注意的是,这种现象已被描述为来自美国的 AMPV-C 病毒株,其中 G ORF 被报道为 783 nts、1321 nts 或 1798 nts [97,98,99]。这些大小差异是由于位于 G 蛋白 C 末端的外膜域中的缺失造成的。对于 AMPV-C 的“科罗拉多”株,G 基因的长度最初被报道为 783 nts,但后来被揭示为 1798 nt [100]。导致 G ORF 变异的机制及其对病毒适应性的潜在影响仍未完全理解。一种假设是,源自野生鸟类的 AMPV-C 病毒株可能在感染后及随后通过火鸡的连续传代中失去了部分 G 基因外膜域 [100]。为了研究这些现象,已经进行了研究,调查 AMPV-C 分离株在细胞培养中的连续传代。Velayudhan 和同事报告说,从家禽火鸡中获得的临床 AMPV-C 分离株在 Vero 细胞中的连续传代导致 G 蛋白的截断 [100]。关于 G ORF 长度的混合病毒群体在低和高传代水平的存在表明,G 蛋白的截断也发生在家禽火鸡中的病毒复制之后 [100]。相比之下,来自野生鸟类的不同 AMPV-C 分离株(aMPV/加拿大鹅 15a/01)在 Vero 细胞中经过五十次传代并未导致 G 蛋白的截断 [101]。在体外和体内研究中分析含有 585 aa 的 G 或 252 aa 的截断短 G 的重组 AMPV-Cs 表明,截断的 C 末端对病毒生存并非必需,并假设该区域在增强附着特异性和宿主免疫中发挥作用 [102]。
副流感病毒 F 蛋白是一个539个氨基酸(HMPV)或537–538个氨基酸(AMPV)的三聚体I型膜糖蛋白 (Table 1) [84],并介导病毒包膜与宿主细胞膜的融合,以及细胞间的侧向融合,导致在感染的转化细胞系中形成合胞体。F 蛋白最初合成为一个无活性的前体 F0,该前体在单一碱性位点被宿主蛋白酶水解切割为功能性二硫键连接的亚单位 F1 和 F2 [103]。HMPV 的临床分离株需要在细胞培养基中添加外源性胰蛋白酶,以获得体外有效感染,因为 F 蛋白在细胞内未被切割 [104]。一些实验室适应的 HMPV 菌株在缺乏胰蛋白酶的情况下生长的能力是由于在假定的切割位点基序中获得了氨基酸替代(S101P) [105]。胰蛋白酶在触发 AMPV F 蛋白细胞融合中的作用更为不确定。AMPV-B 菌株可以独立于胰蛋白酶进行繁殖,切割由 TMPRSS12 媒介 [106]。细胞间融合研究表明,AMPV F 蛋白要么不需要胰蛋白酶来诱导细胞融合 [107],要么 AMPV-B F 蛋白确实需要外源性细胞融合的存在 [108]。这种差异可能是由于 F 蛋白来源的 AMPV 菌株的传代历史或在瞬时质粒表达系统中标准化副流感病毒 F 蛋白表达的问题。
大气道合胞病毒的F蛋白不依赖于附着蛋白G来介导病毒颗粒与宿主细胞膜的融合,这意味着G蛋白对转化细胞系中的病毒生长是可有可无的 [90,92]。此外,HMPV F蛋白在细胞表面附着中也起着作用,通过与宿主细胞表面整合素αvβ1结合一个保守的Arg-Gly-Asp (RGD) 基序 [109]。类似地,AMPV-B诱导的病毒结合和细胞融合受到F蛋白中保守的Arg-Asp-Asp (RDD) 基序与整合素αvβ1之间相互作用的调节 [110]。AMPV-A和aMPV-C F蛋白中存在的类似RDD和Arg-Ser-Asp (RSD) 基序在aa 329–331之间似乎也在通过假定与整合素结合来调节细胞融合 [110]。一般来说,相关副黏液病毒的F蛋白诱导的膜融合发生在中性pH下 [111]。然而,在一些研究中,低pH下的融合在某些但不是所有含有F蛋白中G294或K294的HMPV株中增强 [112,113]。触发AMPV F蛋白诱导的细胞融合所需的低pH也不明确。Wei及其同事报告称,低pH不是AMPV F蛋白诱导的细胞融合的必要条件 [108],而后来的研究显示AMPV-C诱导细胞融合需要低pH [107]。F蛋白也被假设为宿主嗜性的主要病毒决定因子。这是基于de Graaf及其同事在2009年的一项研究,该研究中研究了含有AMPV-C个别基因的嵌合HMPV在哺乳动物和鸟类细胞系中的生长和嗜性。含有AMPV-C F蛋白的嵌合HMPV病毒在鹌鹑成纤维细胞系(QT-6)中比HMPV更有效地复制 [114]。
metapneumoviruses的SH蛋白是一种类型II的整合膜糖蛋白,APMV为174–175个氨基酸 [115],HMPV为177–183个氨基酸(表1) [72,84],被认为作为一种病毒孔蛋白,改变膜的通透性 [116]。SH蛋白在复制中似乎是可有可无的,因为缺乏SH(delta SH)基因的重组HMPV在体外和体内模型中仅轻微减弱 [90,91]。虽然重组AMPV-delta-SH也可以被拯救,但在体外病毒滴度降低,合胞体斑块大小增加,感染火鸡中的病毒复制与野生型AMPV相比减少 [93,117]。SH蛋白可能在调节先天免疫反应中也有作用,因为用重组HMPV-delta-SH感染人类浆细胞样树突细胞时,与野生型病毒相比,干扰素α的分泌增加 [118]。重要的是要注意,到目前为止描述的每个临床metapneumovirus分离株都包含完整的SH ORF。然而,在细胞培养中HMPV的连续传代过程中,SH基因容易发生移码或点突变,从而消除蛋白的功能,并似乎在细胞培养中提供选择性优势 [119]。SH蛋白的瞬时表达显著降低F蛋白促进的融合活性 [116],这表明SH蛋白缺失可能对HMPV在转化细胞系中的生长有利的一个机制。
HMPV是一种人类呼吸道病毒,尚无已知的动物宿主,但在濒危的大猩猩(Gorilla beringei beringei)和黑猩猩(Pan troglodytes)中已报告了人兽共患感染 [120,121,122,123,124,125]。来自一只在呼吸道疾病暴发期间死亡的雌性野生大猩猩的“桑巴纳”HMPV株(GenBank登录号HM197719),一种B2亚型株,显示出与巴西“STA755” B2株(GenBank登录号MG431250)99.54%的序列同一性 [120,126]。此外,贝叶斯系统发育分析显示桑巴纳B2株与从南非分离的其他B2株之间存在密切的进化关系 [120]。病理分析显示上呼吸道有病变,提示病毒感染,同时伴有与_肺炎链球菌_和_克雷伯氏肺炎杆菌_的继发性感染相关的支气管肺炎。感染源未确定,因为HMPV感染的大猩猩在暴发早期就死亡,并且未与公园工作人员或兽医接触 [120]。来自血清学数据的进一步证据表明非人类灵长类动物中可能存在人兽共患HMPV感染 [127]。
在过去二十年的HMPV研究中,已经建立了几种动物模型,这些模型对病毒复制表现出不同程度的允许性。由于试剂的可用性、易于处理和较低的成本,鼠标(Mus musculus)模型在HMPV研究中占据了主导地位 [128]。然而,根据研究的具体重点,由于缺乏与人类自然感染相近的疾病过程,它可能被视为一种有限实用性的模型 [128]。鼠标模型在阐明病毒致病性的一些方面以及疫苗和抗病毒药物的开发中是有用的。已显示出允许性的两种鼠标品系是BALB/c [129,130]和C57BL/6小鼠 [131,132],在接种HMPV后表现出气道阻塞、过度反应、体重下降、毛发蓬乱和蜷缩行为 [133,134,135]。然而,必须注意到数据的不一致性确实存在,可能是由于实验设置的差异。一些研究报告称BALB/c小鼠几乎没有或没有允许性 [136,137,138]。这可能是由于使用的病毒株和剂量、鼠标品系的近交、病毒检测的时间点以及个体处理的差异(在 [128] 中回顾)。棉鼠(Sigmodon hispidus)也被研究作为HMPV感染的小型动物模型,可能是由于其在RSV领域的成功使用 [133,137,139,140]。几项研究表明,棉鼠对HMPV感染的允许性高于小鼠和叙利亚金仓鼠(Mesocricetus auratus) [137,138,139],尽管感染的棉鼠未表现出明显的临床疾病 [128,133,137,139]。与鼠标模型相比,棉鼠确实显示出与HMPV感染的猕猴(回顾于 [128])相似的肺部组织病理变化。其他易感的小型哺乳动物包括豚鼠(Cavia porcellus)、叙利亚金仓鼠和雪貂(Mustela furo) [85,136,137,138,141],它们表现出不同程度的病毒复制、临床表现和体液反应,主要取决于实验设置。已显示仓鼠和雪貂支持HMPV的高滴度复制,导致肺部组织学变化而没有明显的临床疾病和高水平的病毒中和抗体 [136]。
猕猴 (Macaca fascicularis)、恒河猴 (Macaca mulatta)、非洲绿猴 (AGM, Chlorocebus aethiops) 和黑猩猩均已被证明对 HMPV 感染具有易感性 [136,142,143]。在 2004 年,Kuiken 和同事评估了六只猕猴的 HMPV 感染情况,涉及病毒排泄、病毒抗原分布和相关病理损伤 [142]。病毒复制仅限于呼吸道,导气道出现轻微的多灶性糜烂和炎症变化,肺泡内巨噬细胞数量增加。病毒抗原表达主要限于纤毛上皮细胞的顶表面。临床发现为亚临床或轻微,与免疫功能正常的中年成人观察到的情况相对应 [142]。恒河猴在感染后表现出 HMPV 的最小复制,尽管该物种来源的细胞培养对病毒复制的易感性表明,其他宿主因素限制了体内病毒感染 [136]。相比之下,非洲绿猴 (AGM) 支持更高水平的病毒复制,并在感染后显示出高滴度的中和抗体,因此成为评估潜在 HMPV 疫苗候选者的体内研究模型 [91,136]。此外,针对 A 亚群的抗体也中和 HMPV B 亚群,暗示可能不存在与基因型存在相关的血清学相关性 [143]。尽管在 HMPV 感染的 AGM 中无法重现类似人类疾病的肺炎或细支气管炎,但该模型代表了研究 HMPV 感染的免疫、疫苗和治疗的最佳灵长类动物模型 [128,136]。黑猩猩作为 HMPV 感染的体内模型的首次也是唯一一次使用是由 Skiadopoulos 和同事进行的,他们发现黑猩猩能够重现人类观察到的呼吸系统疾病 [143]。在这项研究中,研究了 31 只动物,其中 61% 对 HMPV 抗体呈阳性,表明黑猩猩可能自然感染 HMPV。血清阳性的黑猩猩在 HPMV 再感染中受到保护,而血清阴性的动物在感染 HMPV 后出现呼吸症状。此外,在病毒清除后,黑猩猩在 HMPV 亚型独立的情况下也受到再感染的保护。出于明显的伦理原因,自该研究发表以来,黑猩猩未被用作 HMPV 感染的动物模型。
van den Hoogen 等人进行的初步实验感染火鸡和鸡的研究未能提供数据表明鸡或火鸡对 HMPV 感染是易感的 [14]。相反,Velayudhan 和同事进行的一项更大规模的研究中,2 周大的火鸡雏鸟被感染了四种 HMPV 亚型(当时称为 A1、A2、B1 或 B2),显示 30%–70% 的鸟在接种后四到九天内出现水样到浓稠的粘液分泌和眼眶周围肿胀 [144]。四种亚型均在火鸡中引起了短暂的 HMPV 感染,临床表现、在鼻腔中检测到病毒 RNA 以及组织病理学检查均表明了这一点,但未能证明有血清转化或传染性 HMPV 的恢复 [114,144]。2009 年的第三项研究中,火鸡雏鸟被感染了 HMPV B1 亚型和 AMPV-C,报告了 AMPV-C 的复制,但未发现 HMPV [114]。尚不清楚为什么两项研究未能检测到火鸡雏鸟中的 HMPV 复制,但不同菌株的传代历史可能是一个影响因素,鸟类的年龄和背景也可能起到作用。未来的研究可以通过使用病毒序列已确认与原始患者样本中存在的序列相同的 HMPV 菌株来澄清这些问题。还应对感染鸟类的实验前和实验后病毒序列进行下一代测序,以澄清是否需要突变以提高病毒复制率。
尽管AMPV也被称为火鸡鼻气管炎病毒,但所有四种已知亚型已被证明能够感染许多家禽和野生鸟类。
AMPV A 和 B 是最常被检测到的亚群,主要感染属于鸡形目(Order Galliformes)的物种,包括火鸡和鸡,这可能导致家禽养殖者遭受重大经济损失。这种宿主嗜性在实验条件下也得到了再现,并且在这些物种感染 AMPV 时观察到的临床症状存在差异 [145]。火鸡表现出明显的呼吸道症状,包括干性气管咳嗽和粘液分泌,而鸡则往往表现出较轻的疾病,主要遭受由继发性细菌感染引起的并发症 [42,146,147]。截至目前,尚未在鸭子中报告 AMPV-A 和 B 的自然感染 [145]。
AMPV-C 病毒株可以分为两个谱系,即美国火鸡株,已知是导致 1990 年代和 2000 年代初美国火鸡养殖场疫情的病因,以及主要感染鸭类物种的欧亚鸭株 (图 1)。最近的一项实验研究表明,属于美国火鸡谱系的 AMPV-C 病毒株能够感染火鸡和鸡,而来自欧亚谱系的 AMPV-C 病毒株则可以感染火鸡和鸭子 \145\]。在早期研究中,鸡、北京鸭 (Anas platyrhynchos domestica) 和穆斯科维鸭显示出血清转化,但在感染美国火鸡谱系 AMPV-C 病毒株后没有出现临床症状 \148,[149](#B149-viruses-14-00677)]。已知欧亚谱系病毒株感染鸭类物种,并在穆斯科维鸭中引发疫情,感染鸟类出现呼吸道症状和产蛋下降综合症。由于基因组序列数据有限,一种尚未被归类为两种已识别 AMPV-C 亚谱系之一的 AMPV-C 病毒株在 2012 年在中国导致鸡只出现严重的呼吸道症状 \53]。这仍然是唯一报告的鸡只出现症状的 AMPV-C 感染疫情。
AMPV-D 于1985年在法国的火鸡中被分离过两次,此后未再出现 [57]。在实验条件下,AMPV-D 已被证明对火鸡适应良好,导致接种火鸡和接触鸟类出现感染的临床症状 [145]。接种的鸡只发生了血清转化,但从气管中提取病毒RNA和病毒分离均未成功,表明鸡只中病毒复制有限 [145]。
尽管AMPV于1978年首次在南非的火鸡中被分离,但AMPV的真正起源仍然未知。然而,AMPV在英国的快速传播以及早期英国株与原始南非株的密切关系表明,野生和迁徙鸟类在AMPV传播中可能发挥了作用 [150,151]。在美国早期AMPV-C疫情之后,野生和迁徙鸟类在AMPV传播到家禽中的作用成为主要研究重点。许多野生鸟类被证明对AMPV RNA呈阳性,包括加拿大鹅 (Branta Canadensis)、家麻雀 (Passer domesticus)、燕子 (Hirundo rustica) 和欧洲星鸦 (Sturnus vulgaris) [152]。在疫情期间,放置在火鸡农场附近的哨兵鸭的研究表明,鸭子可能携带传染性病毒 [152,153]。从明尼苏达州的家麻雀和环嘴鸥 (Larus delawarensis) 以及来自加拿大萨斯喀彻温省的雪鹅 (Anser caerulescens) 中获得的样本也被发现对AMPV-C呈阳性 [50]。2002年的另一项研究发现,加拿大鹅和蓝翅绿头鸭 (Spatula discors) 的拭子样本呈阳性 [154]。2008年,Turpin及其同事通过在乔治亚州的美国水鸡和乔治亚州及俄亥俄州的加拿大鹅中检测到AMPV-C RNA,扩展了AMPV在美国的已知地理范围 (18568663)。这项研究还在乔治亚州、南卡罗来纳州、阿肯色州和俄亥俄州的美国水鸡、美国乌鸦、加拿大鹅、牛白鹭和岩鸽中检测到了AMPV抗体 [155]。2011年,AMPV-A和AMPV-B在巴西的野生鸽子 (Columba livia) 和其他多种野生鸟类中被报告存在 [156]。AMPV-C于2012年首次在欧洲被检测到,出现在绿头鸭 (Anas platyrhynchos)、灰雁和普通鸥中,使用了全参数性副黏病毒和肺病毒RT-PCR检测 [157],最近在欧亚秋沙鸭 (Mareca Penelope) 中也被检测到 (35261311)。AMPV-C还于2017年在加拿大安大略省的野生水鸟中被检测到,包括美国黑鸭 (Anas rubripes)、美国秋沙鸭 (Mareca americana)、蓝翅绿头鸭 (Spatula discors)、绿头鸭、北方铲嘴鸭 (Spatula clypeata)、木鸭 (Aix sponsa) 和环颈鸭 (Aythya collaris) [158]。AMPV-A于2019年在巴西的不同野生鸟类中被检测到,距其在该国商业群体中最后一次检测已有五年 [159]。综合这些研究表明,迁徙鸟类很可能作为无症状的储存宿主,但可能将AMPV传播给家禽。
对AMPV感染哺乳动物的能力进行的研究很少。Wei及其同事的一项研究表明,AMPV-C可以在小鼠的肺部复制并持续至少21天,并伴随肺组织的组织病理损伤的发展 [160]。这些小鼠在接种后的第一天到第五天表现出包括发热和呼吸困难在内的临床病症。AMPV感染人类的潜力尚不清楚,但可以假设,先前感染HMPV会对这种人畜共患感染提供一定程度的交叉保护免疫。2011年在美国对火鸡肉加工工人和对照个体进行的初步横断面血清调查显示,前者与对照组相比,之前感染AMPV的几率增加,这表明接触火鸡的职业暴露是人类感染AMPV的一个风险因素 [153]。然而,得出的结论是,需要更多的研究来验证这些发现,识别AMPV传播的可能方式,并确定与假定的人类AMPV感染相关的风险因素。
近年来,下一代测序技术在病毒发现领域变得无处不在,使得对野生物种、家畜和人类的新型病毒的部分和完整基因组序列的特征化数量不断增加。这包括发现了一种新的猪正肺病毒 [161],它补充了之前描述的哺乳动物正肺病毒,这些病毒属于肺病毒科,包括呼吸道合胞病毒(RSV)、牛呼吸道合胞病毒(bRSV)、犬肺炎病毒(CnPnV)和小鼠肺炎病毒(PMV) [83]。有趣的是,只有在鸟类和人类样本中检测到了变肺病毒序列,作为自然宿主。变肺病毒缺乏其他确认的哺乳动物自然宿主,这表明AMPV可能是直接从某种鸟类传播到人类,而没有感染中间的哺乳动物宿主,最终在人体内成为地方性病毒。考虑到发现几种RNA病毒,包括流感病毒,能够直接从鸟类传播到人类宿主,而不需要中间的哺乳动物宿主,这种情况并非不可能。鸟类免疫系统的独特特征 [162,163,164,165,166,167] 可能促进大量病毒在较长时间内的排出,并导致对许多病毒的耐受性,从而促进病毒的进化、传播和跨物种感染 [147,157]。显然,进一步研究AMPV在野生鸟类中的感染动态将是有趣的。
副呼吸道病毒的研究在病毒在细胞培养中的传播方面继续面临相当大的技术挑战。考虑到众多研究的数据,副呼吸道病毒可能需要进行几次体外传代才能产生显著的细胞病变效应,这取决于病毒株或更一般地说,取决于实验室的设置。在特定细胞系中传代病毒分离株使病毒能够适应这些人工环境,产生生长更高效的突变变体。尽管这些经过实验室适应的突变分离株在未来实验中产生更高的滴度,但它们不一定反映流行的野生型病毒的表型。对于未来的副呼吸道病毒研究,特别需要注意重组病毒的全基因组共识序列与来自鸟类或人类的原始临床拭子材料中的序列相同。一般来说,预实验和后实验对分离株进行测序对于定义适应新宿主的分子基础至关重要。元基因组学在过去十年中也促进了可用的副呼吸道病毒完整基因组序列数量的快速扩展,特别包括从临床样本中生成的新型高度分歧的僧侣鹦鹉和鸥类AMPV株的序列。总体而言,这可能需要更新的分子钟模型来重新评估AMPV-C和HMPV的分歧日期。
总之,深入了解HMPV的进化起源以及对副呼吸道病毒跨物种感染的障碍,将需要更好地理解AMPV-C和HMPV之间的分子和表型差异。这将需要基于使用保留临床样本中共识序列的病毒分离株进行更严格的研究,并结合鸟类和人类呼吸上皮的体外和体外初级细胞模型。阐明一种鸟类病毒如何进化为地方性人类呼吸病毒的机制,可能为更好地理解人畜共患病毒如何绕过跨物种病毒感染的障碍提供宝贵的经验。
S.T.J.、M.L. 和 A.D.M.E.O. 撰写并编辑了手稿。所有作者均已阅读并同意发表的手稿版本。
S.T.J. 的研究得到了德国研究基金会(DFG; Deutsche Forschungsgemeinschaft)-398066876/GRK 2485/1 的资助。这项开放获取出版物得到了德国研究基金会(DFG,Deutsche Forschungsgemeinschaft)在 LE 824/10-1 “开放获取出版费用” 项目下的资助,以及汉诺威兽医大学的资助。
不适用。
不适用。
不适用。
作者声明没有利益冲突。
本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。
不适用。
来自病毒的文章在此提供,感谢 多学科数字出版机构 (MDPI)